José Carlos Peña
Introducción
La litiasis renal es un problema de salud pública que nunca se ha resuelto y que ha continuado con una incidencia que no ha decaído con el tiempo, por el contrario, se ha incrementado, sobre todo en mujeres y sin duda el cambio climático favorecerá aún más su crecimiento. En los estados más afectados por el calor en los EUA, el riesgo de nefrolitiasis crecerá de 40 % en el año 2000 a 56 % en el 2056 y a 70 % para el año 2095 de acuerdo a investigadores norteamericanos. En los años 80, la introducción de la litotripsia y la cirugía percutánea revolucionó el tratamiento de la litiasis renal pero no su incidencia; de hecho, la calidad de vida de muchos de estos enfermos, nacida de información anecdótica en consultas y conversaciones, revelaron la insatisfacción por el statu quo y especialmente por la falta de medidas preventivas efectivas en el control de esta enfermedad.
Epidemiologia
La litiasis renal afecta a 4 % de la población mundial en una relación de 4:1 entre hombres y mujeres. Se asocia a gran morbilidad y cuadros dolorosos intensos (cólico renoureteral). El diagnóstico debe ser precoz para evitar infecciones urinarias, uropatía obstructiva y daño renal. En EUA, la prevalencia de la enfermedad es igual que la diabetes, afecta 1/11 individuos y en los últimos 15 años, casi se ha duplicado.1,2
A lo largo de los años, se ha acumulado evidencia que muestra que la nefrolitiasis se asocia con otros padecimientos, tales como: hipertensión arterial, diabetes mellitus tipo II, obesidad y dislipidemia,3-10 todas ellas son factores de daño CV (cardiovascular). Es más, la litiasis renal se asocia con un mayor riesgo de enfermedad crónica del riñón e insuficiencia renal,3 dos factores adicionales. Se ha encontrado que los formadores activos de cálculos renales tienen un mayor riesgo de daño CV y de muerte que la población general. En una gran población en Alberta, Canada,3 se encontró que un episodio calculoso se asociaba a un mayor riesgo de enfermedad CV, que incluía infarto agudo al miocardio, muerte por enfermedad coronaria, revascularización con angioplastía y bypass coronario, así como, más AVC (accidentes vasculares cerebrales).
La obesidad, la diabetes mellitus tipo 2 y el síndrome metabólico están asociados a un mayor riesgo de litogénesis.11,12 Con la aparición de la epidemia de obesidad mundial se ha encontrado, desde el punto de vista epidemiológico, un mayor riesgo de litiasis y daño renal en aquellos sujetos con IMC > 30 o un aumento en el diámetro de la cintura.12 Es más, en este grupo el riesgo de diabetes y de síndrome metabólico tiene como problema común la resistencia a la insulina que altera el equilibrio acido básico con el desarrollo de orinas de pH ácido que favorecen la formación de cálculos de ácido úrico. Por otra parte, la alimentación de esta población se acompaña de la ingestión en exceso de azucares, proteínas, purinas, sodio, calcio y oxalatos; así como, de volúmenes urinarios bajos (< 1500 ml), todos son factores que favorecen la formación de cálculos de sales de calcio (oxalato y fosfato) y ácido úrico.
Por ello, los médicos en presencia de un episodio de litiasis deben tener en cuenta el riesgo al que estos enfermos están sujetos por sus morbilidades asociadas.
Fisiopatología
La formación de piedras es el resultado de una mezcla de tres factores: SS (sobresaturación) de la orina con sales con el potencial litogénico, presencia de elementos químicos y físicos promotores de la nucleación, y baja concentración de los inhibidores la nucleación. Por lo tanto, la formación de cálculos puede resultar de la combinación de diversas causas:
- Volumen urinario bajo (sobre todo en climas cálidos).
- Aumento en la excreción y SS de calcio, ácido úrico, oxalato y cistina.
- pH urinario anormal (el ácido úrico y la cistina son menos solubles en pH ácido, la estruvita y el fosfato de calcio son menos solubles en pH alcalino).
- Formación de nidos por precipitación de cristales (placas de Randall a base de apatita, cristalización del urato de sodio que sirve de nido para la formación de piedras de oxalato de calcio).
- Reducción de inhibidores de la nucleación, citrato y magnesio.
- Infección.
- Oxalobacter perfringes en la hiperoxaluria.
La distribución de las sales y otras sustancias son los constituyentes principales de las diversas variedades de cálculos. (Figura 1)
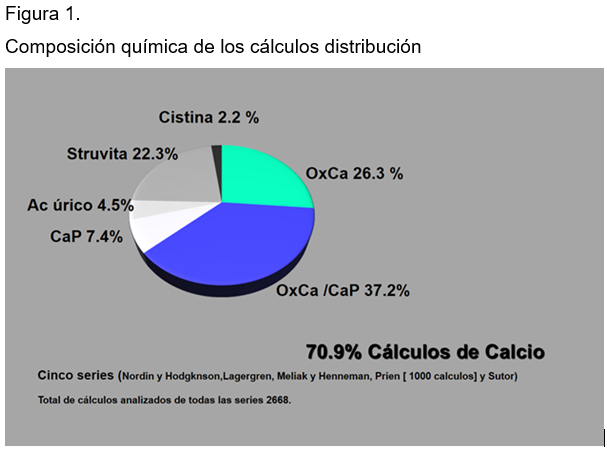
Cuadro clínico
Se caracteriza por dolor cólico intenso acompañado de gran inquietud, hematuria macro y microscópica. La presencia de obstrucción parcial o total unida a una infección puede dañar seriamente el riñón. Hay piedras asintomáticas con o sin nefrocalcinosis asociada, y se diagnostican habitualmente en placas simples de abdomen requeridas por otras razones. Hay casos de estas alojadas en los cálices y que pueden ocasionar dolor lumbar, lo que puede confundirse o diagnosticarse como dolor de origen osteoarticular, muscular, intestinal o psicogénico, pero que al removerse el cálculo, el dolor mejora sustancialmente o desaparece hasta en 80 % de los casos, según las pequeñas series analizadas. Por lo que, un cálculo considerado asintomático no lo es en todos los casos.
La historia clínica debe enfatizar en los antecedentes familiares de litiasis, gota y diabetes; así como la dieta y la ingestión de drogas.
Diagnóstico
Se puede realizar a través de diferentes pruebas. El análisis general de orina puede mostrar hematuria, macro y microscópica. La piuria sugiere la presencia de infección que debe corroborarse con urocultivo y la cristaluria permite en ocasiones sospechar o inferir el tipo de piedra.
La placa simple de abdomen o el ultrasonido renal, sobre todo con la demostración de cálculos radiopacos (85 %), calcio, estruvita o cistina permite establecer el diagnóstico, aun cuando podemos errar en presencia de piedras radio lúcidas a base de ácido úrico y otras. La urografía excretora o la urotomografía permite no solo establecer el diagnóstico, sino también eliminar la posibilidad de obstrucción e hidronefrosis, también es muy útil para diagnosticar la presencia de piedras a base de ácido úrico y de cistina.
Expulsión de cálculos
Los factores más importantes que predicen la expulsión de piedras son su tamaño y localización. En distintos metaanálisis de estudios observacionales, se encontró que 12, 22 y 45 % de las piedras que se eliminaban espontáneamente estaban localizadas en la porción proximal, media y distal del uréter; y 55, 35 y 8 % se expulsaban de acuerdo a su tamaño < 4 mm, entre 4-6 mm y mayores de 6 mm. Sin embargo, las piedras se eliminan después de un tiempo impredecible y de muchos sufrimientos. El tratamiento utilizado ha sido: corticoesteroides, bloqueadores alfa adrenérgicos y bloqueadores de los canales de calcio,13,14 aparte de analgésicos y antiespasmódicos. Los bloqueadores de los canales de calcio reducen la contracción del musculo liso y el espasmo ureteral, los bloqueadores alfa adrenérgicos disminuyen el tono del músculo liso y la frecuencia y fuerza de la peristalsis. (Tabla 1)
| Tabla 1.
Drogas utilizadas en la expulsión de cálculos |
|||
| Dro | |||
| Tipo | Generico | Comercial | Dosis
recomendada |
| Bloqueador del canal de calcio | Nifedipino | Adalat Adalat CC Procardia Procardia XL |
30 mg/día |
| Tamsulosin | Hipebe
Tamblan Secotex |
0.4 mg/día | |
| Bloqueador α1-selectivo | Terazosin | Hytrin | 5 mg/día |
| Doxazosin | Cardura | 4 mg/día | |
| Corticosteroide | Deflazacort |
Calcort |
30 mg/día |
| Glucocorticoide | Metilprednisolona | Depo-Medrol Solu-Medrol |
16 mg/día |
Las guías publicadas en conjunto por la Sociedad Médica Americana y Europea de Urología, recomiendan que para el primer cálculo < 10 mm y de localización ureteral distal se debe intentar tratamiento médico. Sin embargo, no es tan segura esta conducta en cálculos proximales o medios, su comportamiento en los primeros días del cólico renal nos debe servir de guía.15
Recurrencia de episodios de litiasis
La mayoría de los pacientes con un solo episodio de litiasis no son sometidos a una evaluación clínica completa y solo algunos reciben un tratamiento preventivo. Recientemente, el grupo de Rule et al de la Clínica Mayo,16 describió un nomograma para predecir la recurrencia de cálculos renales; para esto seleccionaron pacientes con un solo episodio de litiasis y los siguieron por varios años. Habitualmente, la mayoría de los pacientes lo primero que preguntan a su médico tratante es si este suceso se repetirá en el futuro y que pueden o deben hacer para evitarlo, se les responde con base en los resultados del mencionado artículo, es decir, que la tasa de recurrencia será de: 11 % a los 2 años, 20 % a los 5 años y 31 % a los 10 años.18,19 Estos números pueden motivar a estos enfermos a modificar su dieta (reducir la sal, las proteínas animales y mantener la ingestión normal de calcio) e incrementar su consumo de agua a 2 litros o más al día. Ambas modificaciones han demostrado ser efectivas para reducir la recurrencia en estudios controlados y aleatorizados.18,19 Es importante abundar que en pacientes con altas tasa de recurrencia, es crítico contar con un estudio metabólico completo y considerar el empleo de fármacoterapia con el fin de controlar la recurrencia descrita más adelante.
Estudio metabólico
Para estudiar a estos enfermos, se recolecta una muestra de orina de 24 horas sin conservadores, donde se mide el contenido de calcio, magnesio, sodio, citrato, oxalato, ácido úrico, creatinina y pH. Se obtiene en ayunas de 2 horas para estimar contenido de calcio y creatinina y estimar el cociente calcio/creatinina (Normal 0.11). También, se toma una muestra de sangre en ayunas para cuantificar: BUN, creatinina, ácido úrico, sodio, potasio, cloro, CO2 total, calcio, fósforo, PTHi. Además, se puede calcular en estas muestras la SS para oxalato, fosfato de calcio y ácido úrico. Los cocientes de actividad y de formación para oxalato de calcio y brushita ha sido otro estudio fisicoquímico de la orina que permite estimar el grado de SS.20
Fisiopatología y tratamiento de las distintas variedades de cálculos
Hipercalciuria idiopática
La HI se define como un calcio en orina de 24 horas > 250/mg en mujeres y > 300 mg en hombres (0.4 mg/Kg/día). La relación de calcio/creatinina en orina en ayunas > 0.11. En presencia de hipercalcemia, se debe plantear el diagnóstico diferencial con hiperparatiroidismo primario y otras causas como: hipertiroidismo, sarcoidosis, intoxicación por vit D y procesos tumorales malignos.
La población hipercalciúrica forma 20 veces más cálculos que la población general, es decir, 5 contra 0.25 %. Tradicionalmente, se había aceptado que había cuatro causas que explicaban la fisiopatología de la HI: la perdida renal de calcio, la hiperabsorción intestinal del catión o su movilización excesiva del esqueleto, y la perdida renal de fósforo que se acompaña de hipercalciuria. Las tres primeras, en realidad, son el resultado de la fuga renal de calcio desde sutil hasta muy obvia. En este contexto, la hiperabsorción intestinal de calcio es el resultado y no el origen de la hipercalciuria, que parece ser secundaria a un aumento de la 1,25 D3 a su número de receptores o a ambos. (Figura 2)
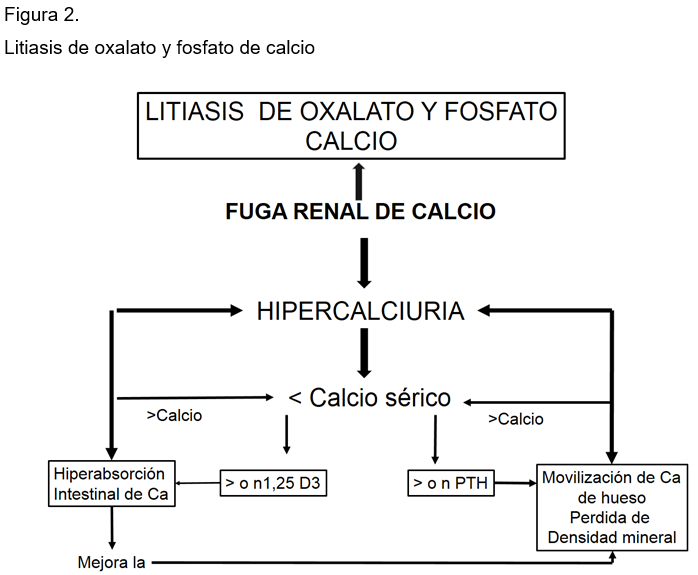
La resorción ósea es un componente habitual de todas las hipercalciurias ya que todos los grupos estudiados desde niños hasta adultos cursan con pérdida de densidad mineral. La hiperabsorción intestinal aunada a una dieta rica en calcio (800 mg o más) o con suplementos de catión puede compensar algo de la resorción esquelética. En conclusión, las causas desencadenantes de la HI son la perdida renal de calcio y la perdida renal de fósforo, a estas se suman factores tales como: dietas altas en sodio y proteínas animales, azúcares, suplementos de calcio y dietas ricas en oxalato, y la reducción en la formación de cálculos. Todo esto se traduce en la formación de placas de Randall en la papila renal a base de hidroxiapatita, sobre las que se depositan sales de oxalato de calcio unido a defectos en el sistema de inhibición de la cristalización (citrato, magnesio, hidratación y otros). Debido a la heterogeneidad en su presentación clínica, es difícil explicar cuál de estos defectos sea el responsable de esta condición, en la mayoría de los pacientes con litiasis renal por oxalato de calcio y fosfato de calcio.21
Como se sabe, entre 60 y 70 % de los cálculos están constituidos por sales de calcio y la etiopatogenia de la mayoría de ellos es la HI. Dentro de los pacientes con este trastorno hay formadores de piedras de calcio a base de CaOx (oxalato de calcio) y otros por sales de fosfato de calcio o CaP (apatita). Se ha demostrado que los cálculos de CaOx se forman sobre las CaP o placas de Randall asentadas en el intersticio renal. Entre mayor es la excreción urinaria de calcio, menores los volúmenes urinarios, pero mayor será el número de placas y mayor la recurrencia de los episodios de litiasis. El cristal que se agrega sobre las placas de Randalll es CaOx y la piedra resultante estará compuesta fundamentalmente por esta sal. Por lo que la reducción de la SS de las sales de CaOx y de CaP nos ofrece una medida de prevención de la formación de estas piedras. Los cálculos en la HI por CaP en contra de los de CaOx, favorecen los depósitos de cristales de apatita en los tubos colectores de la médula interna y el desarrollo de cicatrices en el intersticio renal en la punta de la Papila.21
Ambos formadores de cálculos cursan con hipercalciuria, sin embargo, los sitios de la nefrona donde ocurre esta alteración son distintos. Por ejemplo, la reducción en la reabsorción proximal acarrea más calcio hacia la RAAH (rama ascendente del asa de Henle), donde el exceso de reabsorción de calcio satura el intersticio y favorece la formación de placas de Randall. En este mismo sitio, esta reabsorción anormal en la HI por fosfato se asocia a un defecto en la reabsorción de bicarbonato que produce un aumento del pH urinario característico de esta variedad de hipercalciuria que favorece la formación de cálculos de CaP. El CaSR (receptor sensible a calcio) se localiza, entre otros lugares, en la porción apical de las células principales e intercaladas del tubo colector, durante la hipercalciuria se activa el CaSR que se asocia a desactivacion de la AQP2 (Acuaporina 2) y a poliuria, y además, dispara la acidificación de la orina al aumentar la actividad de H-ATPasa. Ambas, la poliuria y la acidificación urinaria, evitan la precipitación de las sales de CaP. Estos hallazgos en animales de laboratorio permiten intuir que, en nuestros pacientes con litiasis renal, la poliuria y la acidificación de la orina son también un mecanismo que permitirá evitar el depósito de CaP en el intersticio renal. Se especula que en el futuro, los procedimientos que activen el CaSR como sería el uso de calcimiméticos (Cinacalcet) podrán desempeñar un papel terapéutico relevante en la litiasis cálcica recidivante.22 Aparte de lo mencionado, el tratamiento preventivo para ambas variedades de HI es: restricción de sodio y proteínas,19 uso de tiazidas (clorotiazida, clortalidona e indapamida) y un aumento en la ingestión de agua con diuresis de 2 a 2.5 litros por día. Este Rx actúa sobre ambas variedades de hipercalciuria idiopática por CaOx y por CaP.
Es importante señalar que el uso de la mayoría de las drogas que se utilizan en el tratamiento de la litiasis recurrente tiene más de 30 años de antigüedad. Por lo que no hay tratamientos diferentes para el manejo de las piedras de oxalato o fosfato de calcio tal como se señala arriba y tampoco hay tratamientos novedosos.21-28 (Tabla 2)
| Tabla 2.
Drogas de uso común en el tratamiento de nefrolitiasis cálcicahipercalciúrica |
||
| Droga | Dosis recomendada | Comentarios |
| Hidroclorotiazida | 50 mg/día 25 mg dos/día |
Una sola dosis es preferible ya que dos dosis puede causar nocturia y el paciente no esta tranquilo. |
| Clortalidona | 25 mg/día 50 mg/día |
Ambas dosis reducen el calicio urinario igulamente. Debido a su larga acción, este tratamiento puede causar hipokalemia e hipocitraturia
. |
| Indapamida | 1.2 mg/día 2.5 mg/día |
Este tratmiento puede tener menos efectos indeseables que la hidroclorotiazida, que incluye la aparición ocasional de hipokalemia e hipotensión. |
| Amiloride | 5 mg/día | El tratamiento diurético con ahorradores de potasio también reduce el calcio urinario pero en un grado menor que la hidroclorotiazida. |
| Amiloride/Hidroclorotiazida | 5 mg/50 mg/día | Mantiene el efecto hipocalciurico de la tiazida, y evita el desarrollo de hipokalemia grave. |
Hipocitraturia
La hipocitraturia es el origen de 20 % de la litiasis cálcica. Una excreción menor de 500 mg en la mujer y 350 mg en el hombre corresponden al criterio clínico para establecer el diagnóstico de citrato urinario bajo. El estudio metabólico de la litiasis que incluye el estudio del citrato permite establecer este diagnóstico.
El citrato, ya sea de sodio o de potasio, es una sal alcalina que se une al calcio urinario y reduce su tendencia a formar cristales de oxalato y de fosfato de calcio.30,31
La concentración de citrato urinario está determinada por la reabsorción tubular que se incrementa con cargas ácidas y se reduce con cargas alcalinas. Por eso, la pérdida de sales alcalinas, como diarreas, ATRD (acidosis tubular renal distal) o cualquier causa de acidosis metabólica reduce la excreción urinaria de citrato.32La depleción de potasio común en los enfermos que reciben tiazidas también reduce la citraturia, que se recupera con el empleo de suplementos de potasio. Hay pacientes que excretan menores cantidades de citrato en orina sin causa aparente; sin embargo, los mecanismos que lo determinan se desconocen en la actualidad. Estos formadores idiopáticos de piedras de oxalato o fosfato de calcio se benefician grandemente con el empleo de sales de citrato de potasio que pueden reducir la recurrencia, si hay hipercalciuria asociada y esta no se abate con el citrato se sugiere asociarlo a tiazidas. De hecho, al tratamiento con drogas diuréticas es siempre aconsejable acompañarlo con sales de citrato de potasio; esta maniobra tiene dos efectos, el primero es sustituir la perdida de potasio que ocurre con los diuréticos y el segundo aumentar los valores de citrato urinario que contribuye al control de la litiasis cálcica. El uso de topiromato en el tratamiento de la epilepsia reduce el citrato urinario y favorece la formación de cálculos.33
El citrato de potasio es una sal alcalina que se metaboliza en el hígado a bicarbonato. Se debe utilizar a dosis de 1-2 g tres veces al día y debe administrarse en cápsulas de gelatina seguidas de un vaso de agua, aunque puede producir diarrea, flatulencia, náusea, dolor abdominal y ocasionalmente vómito, pero estas molestias son leves, poco frecuentes y ceden con el tiempo. En general, esta sal es bien tolerada y sin efectos tóxicos agregados. También se ha utilizado agua de limón como fuente de citrato. 34
Hiperuricemia e hiperiuricosuria
Las piedras de ácido úrico se presentan en entre 4.5 y 5 % de diversas series. Son tres los factores más importantes que determinan la formación de cálculos de ácido úrico: volúmenes urinarios bajos, pH urinario ácido (menor de 5.5) e hiperuricosuria. (Figura 3)
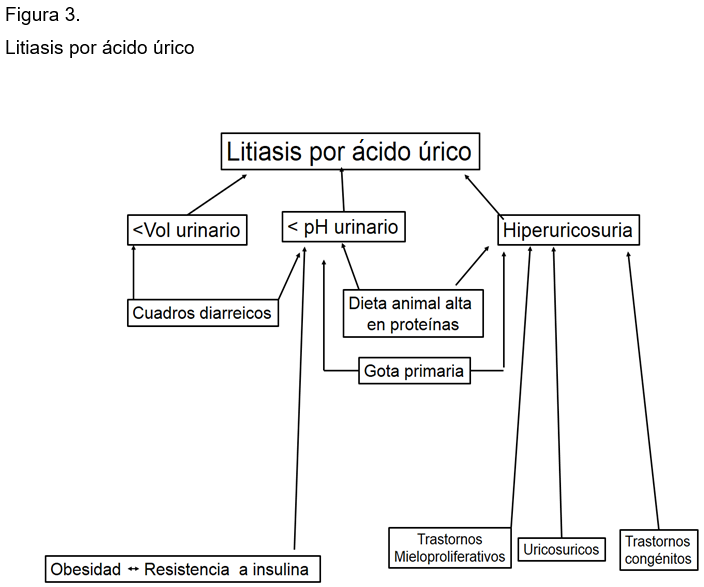
La oliguria o la presencia de volúmenes menores de mil ml con frecuencia ocurren por ingerir pocos líquidos, por cuadros de deshidratación por calor extremo o por diarreas. El pH ácido es secundario a cuadros diarreicos por pérdida de bicarbonato, a dietas rica en proteínas animales y acompaña a la obesidad con resistencia a la insulina. La hiperuricosuria es secundaria a dietas altas en purinas e hiperuricemia por gota primaria. Otras causas son los procesos mieloproliferativos al ser tratados con antitumorales, empleo de drogas uricosúricas y trastornos congénitos. En el pH ácido (< 5.5), la mayor del ácido úrico es poco soluble en orina y solo 100 mg de este está en forma de uratos, por lo que su SS está muy elevada y desarrolla cristaluria y piedras de ácido úrico. (Figura 4)
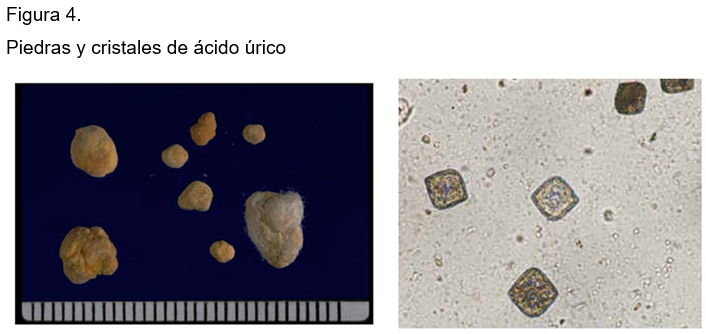
Los análisis químicos o espectroscópicos permiten identificar las piedras de ácido úrico u otra variedad de sales (xantina y 2,8DHP 2,8 dihdroxiadenina). Los pacientes con gota tratados con alopurinol desarrollan xantinuria y cálculos por este compuesto, que se ve también en pacientes con sindrome de Lesch Nyhan o con xantinuria idiopática. Otros enfermos con defecto en la fosforibosiltranferasa excretan grandes cantidades de 2,8 DHP y forman cálculos de este compuesto los cuales se pueden confundir con piedras de ácido úrico. El diagnóstico también incluye a las piedras con mezcla de uratos y oxalato de calcio.
Los cálculos de ácido úrico se tratan con alcalinización de la orina con sales a base de citrato de potasio y también con citrato de sodio; de hecho, el alopurinol solo tiene un papel secundario en este manejo.35-40
Un tercio de los pacientes con litiasis cálcica cursan con hiperuricosuria como uno de sus factores de riesgo. Por años, se aceptó que la hiperuricosuria favorecía la formación de cálculos de OxCa, sin embargo, estudios epidemiológicos recientes no han demostrado claramente esta asociación. La presencia de ácido úrico in vitro favorece la precipitación de sales de oxalato de calcio (desalar), sin embargo, esto no se ha probado en vivo. Este mecanismo de desalar simplemente es la habilidad de un compuesto de ácido úrico de reducir la solubilidad de un no electrolito, en este caso el oxalato de calcio. Muchos estudios pequeños no muy bien controlados, demostraron que el uso de alopurinol reduce la excreción de ácido úrico y la formación de cálculos de oxalato de calcio.36 En uno de estos estudios, la hipótesis era que el alopurinol un inhibidor de la xantino oxidasa (ahora conocida como xantino-reductasa o xantino-deshidrogenasa) disminuiría la hiperuricosuria (> 800 mg en hombres y > 750 mg en mujeres) en pacientes con normocalciuria (mujeres < 250 mg y hombres con < de 300 mg de calcio en orina de 24 horas) y la formación de cálculos de OxCa. Los pacientes fueron aleatorizados a recibir 100 mg de alopurinol tres veces al día o placebo. Los que recibieron droga redujeron el ácido úrico a < 400 mg/ día y con placebo de 0 a 100 mg. Ambos grupos disminuyeron sus episodios de litiasis, en el grupo de alopurinol 9 pacientes tuvieron episodios de litiasis y un mayor retraso en la aparición de los episodios de nefrolitiasis,35-37 y en los de placebo fueron 18 casos.
Este estudio existe en el contexto de la heterogeneidad de los datos epidemiológicos, que son insuficientes para demostrar convincentemente que la hiperuricosuria es un factor de riesgo para piedras de calcio. Es más, se ha postulado que el efecto del alopurinol en la litogénesis cálcica, no es secundaria a la caída de la uricosuria sino a los otros efectos que tiene la inhibición de la xantino-oxidasa, ya que esta enzima está ligada a una disminución del estrés oxidativo y de los radicales libres. Sin embargo, la manera en que estos efectos pleiotrópicos de la xantino-oxidasa están ligados a la formación de cálculos es especulativo y no se ha demostrado.
El Febuxostat41,42 es un inhibidor nuevo de la xantino-oxidasa, pero no es un análogo de purina, y fue aprobado por la Food en Drug desde 2009 para el tratamiento de la hiperuricemia en pacientes con gota. Su capacidad de reducir la hiperuricemia y la hiperuricosuria parece ser superior al alopurinol, pero los dos no han sido probados juntos. Mientras que la excreción de alopurinol es por vía renal, el febuxostat es metabolizado en gran medida por el hígado. Se puede utilizar en pacientes con daño renal, aun cuando hay poca información en pacientes con FG menor de 30 ml/min. En formadores de piedras con gota e hiperuricemia, puede ser preferible, sobre todo en pacientes intolerantes al alopurinol o en vez de otros uricosúricos.
La posibilidad de que esta droga sea superior y más eficaz al alopurinol no se ha demostrado. En un estudio publicado por Goldfarb en 2013,43 se incluyeron un total de 99 pacientes con hiperuricosuria (> 700 mg/día), hombres y mujeres, con un episodio calculoso en los últimos 5 años y uno o más cálculos radiopacos de más de 3mm de diámetro en el estudio radiológico. Los pacientes se dividieron en tres grupos de 33 pacientes: el primero recibió 80 mg de Flebuxostat, el segundo 300 mg de alopurinol y el tercero placebo durante 6 meses. Los resultados mostraron un descenso significativo de la uricosuria de 58.5 % con Flebuxostat, 36.4 % con alopurinol y 12.7 % con placebo. Debido al corto tiempo del estudio no se detectó una reducción en los episodios de litiasis ni en el tamaño de los cálculos y tampoco afectó la función renal.
El tratamiento de estos pacientes, como en todas las litiasis, es beber más agua, reducir las purinas de la dieta, medida difícil de sostener por mucho tiempo por lo que el empleo de alopurinol a dosis de variables de 100-300 mg o de Flebuxostat a dosis de 80 mg e diarios, reduce la uricosuria que contribuye a la reducción de los episodios de litiasis.43
Hiperoxaluria
Se define como la excreción de más de 60 mg/24 horas, ocurre en 15 % de pacientes y su hallazgo nos obliga a una investigación más profunda de su etiología. La hiperoxaluria primaria es rara, es autosómica recesiva y se caracteriza por un error innato o ingénito del metabolismo del ácido glioxilico, lo que da lugar a una excreción exagerada de oxalato y a una gran actividad litogénica e insuficiencia renal en la infancia.
La hiperoxaluria secundaria se divide en dos grupos:
- Primer grupo: hiperoxaluria idiopática de origen dietético: la excreción normal de oxalato es de 31 mg/día en mujeres y 41 mg/día en hombres. Por retos dietéticos la excreción de oxalato puede elevarse a 80 mg/día, en pacientes que forman cálculos de oxalato de calcio sin otros trastornos que la expliquen. Hay que investigar en estos enfermos otros orígenes, como la ingestión de ácido ascórbico o la deficiencia en piridoxina. Las dietas bajas en calcio favorecen la absorción de oxalato y las dietas altas lo reducen. 44 (Figura 5)
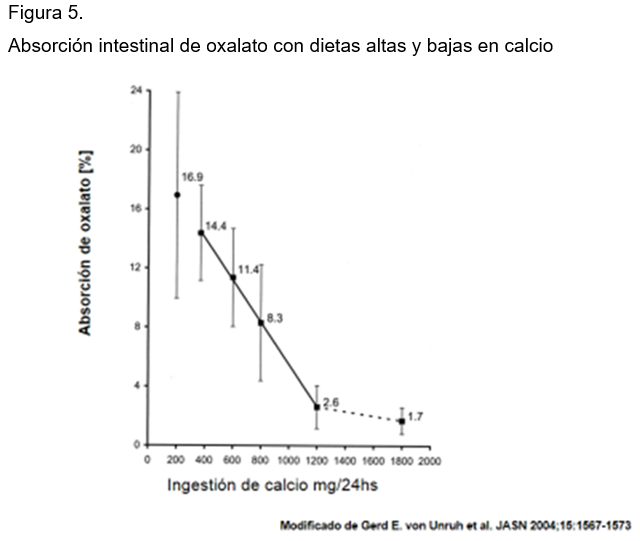
Otra causa de esta condición es la ingestión de dietas ricas en proteínas y alimentos como nueces, cacahuates, avellanas, almendras, betabel, espinacas, chocolate, cocoa, germen de trigo, té negro y otros. La absorción del oxalato depende de los transportadores intestinales. Es interesante señalar que en formadores de estas piedras se ha demostrado la presencia de variaciones genéticas en las proteínas transportadoras de oxalato en el eritrocito.45
Otro factor que se ha estudiado en la fisiopatología de la litiasis por oxalato de calcio es la presencia el intestino de bacterias que degradan el oxalato por medio de la oxalato decarboxilasa, se trata del Oxalobacter Fromigenes. (Figura 6)
La reducción en el número de colonias por el uso de antibióticos (amoxicilina y claritromicina) que afecta la flora intestinal puede ocasionar un incremento en el número de piedras al doble y hasta el triple. El efecto de esta caída en la litogénesis es mayor el primer año y él efecto se reduce a los 5 años.46 (Figura 7)
Segundo grupo:
- hiperoxaluria de origen intestinal:la llegada al colon de residuos intestinales ricos en grasa de causas variables: cirugía bariátricade cortos-circuitos gastrointestinal o yeyuno ileales, enfermedad inflamatoria del intestino delgado, trastornos biliares, resección amplia del intestino, enfermedad exocrina del páncreas y otros. También, la diarrea líquida con pérdida de bicarbonato produce caída del pH y del citrato urinario, que aumenta la SS de oxalato de calcio y mayor precipitación de sales de oxalato de calcio y de ácido úrico. La hiperoxaluria entérica secundaria a cirugía bariátrica con cortos circuitos gastro intestinales se caracteriza por la excreción abundante de cristales de hidroxi-apatita que obstruyen los tubos colectores y producen muerte de células epiteliales e inflamación del intersticio de las áreas vecinas.
La ingestión accidental o por otros motivos de etilen glicol (anticongelante) y la anestesia con metoxifluorano desencadenanm en forma violenta, acidosis metabólica grave e insuficiencia renal aguda por el acumulo intrarenal de cristales de oxalato que de no ser tratadas adecuadamente y con prontitud pueden conducir a la muerte.
El tratamiento de las hiperoxalurias incluye medidas generales, un aumento en la ingestión de agua para obtener diuresis de 2 a 2.5 litros por día, la reducción del oxalato y las grasas en la dieta, hasta donde los requerimientos nutricionales lo permitan. La administración de suplementos de calcio de 500 a 1000 mg en cada comida fijan el oxalato de los alimentos y limitan su absorción:
- Colestiramina: es una resina anhidra muy higroscópica que fija sales biliares, grasas y oxalato. Se administra en polvo (2-4 g tres veces al día) disuelta en agua o con jugo de manzana, se debe mantener una hidratación abundante el resto del día. La colestiramina no se absorbe y su efecto máximo ocurre a los 21 días de iniciado el tratamiento. En vista de que interfiere con la absorción de diversos medicamentos: tiazidas, beta bloqueadores, warfarina, diuréticos de asa, digoxina, AINES (antiinflamatorios no esteroideos) es aconsejable administrar este medicamento 1 hora antes y 4 horas después de las comidas. No se deben dejar residuos en la boca porque remueve el esmalte de los dientes y los decolora.47
- Hiperoxaluria primaria (HP): la mutación de uno dedos genes (AGXT O GR enHPR)aumenta la producción de oxalato y su excreción urinaria a 190-200 mg/24 hs. Existen dos variedades, la tipo I que cursa frecuentmente con insuficiencia renal; el defecto fundamental esta en el gen AGXT que determina la enzima alanina glioxilato amino transferasa (AGT) presente el peroxisoma del higado y que convierte el glioxilato a glicina, el exceso de glioxilato se oxida a oxalato, y sus depósitos son generalizados y se pueden evidenciar en el fondo del ojo. La de tipo II es una forma mas benigna y su alteración se ancuentra en el gen GRHPR que da lugar a la enzima glioxilato/hidroxihipurato reductasa que convierte el glioxilato a glicolato y se caracteriza por hiperoxaluria y aumento del ácido L-glicérico en orina. Esta forma rara vez produce insuficiencia renal. El tratamiento de ambas variedades para evitar la formación de cálculos es aumentar la diuresis a más de 2 litros diarios, piridoxina a dosis de 25ª 200 mg/día y empleo de ortofosfato para alcalinizar la orina. En el caso de la variedad I cuando desarrolla insuficiencia renal, la solución es el trasplante segmentario de hígado y trasplante de riñón.
- Piridoxina (Vit B6): es una vitamina precursoradel piridoxal que funciona en el metabolismo de las proteínas, grasas e hidratos de carbono. La vitamina libera el glucógeno almacenado en el higado y en los músculos y contribuye a la síntesis de acido GABA (g-aminobutírico).En forma normal, la AGT transforma el glioxilato en glicina, con la presencia de piridoxal-5 -Fosfato como coenzima. En ausencia o deficit de AGT, se generan glicolato y oxalato en exceso. La adminsitración de piridoxina a dosis de 250 hasta 500 mg/día permite que la AGT se reubique en los peroxisomas del hígado y reduce la excreción de glicolato y de oxalato urinarios. La piridoxina por vía oral se ha se ha empleado en otras formas de hiperoxaluria y ha reducido la formación de calculos. La vida media de la piridoxina es de 15 a 20 días y su excreción es básicamente urinaria.47
Cistinuria
Es un trastorno autosómico recesivo que ocurre como resultado de una mutación de dos genes que codifican para la única proteína transportadora para cistina y aminoácidos básicos (ornitina, lisina y arginina), localizada en el tubo proximal. Su ausencia genera gran pérdida de cistina, que es un aminoácido poco soluble que se cristaliza en la orina,47-56 especialmente en la ácida. El análisis de orina revela la existencia de cristales hexgonales en 50 % de los pacientes. (Figura 8)

La prueba del nitroprusiato es positiva aunado a valores de cistina que oscilan entre 75–175 mg /gr de creatinina. El diagnóstico se confirma con la medición de la excreción de cistina en 24 horas mayor de 60 mg/gr de creatinina. Las piedras tienen un aspecto como de lajas pequeñas de río de color grisáceo, muy características, que pueden formar cálculos coraliformes y son radio-opacas a los rayos X.
El tratamiento de la cistinuria no ha cambiado sustancialmente en los últimos 30 años. La ingestión de agua para diluir lo cristales de cistina se considera una indicación critica. Los cambios dietéticos, que permanecen sin estudiar incluyen dos maniobras, restricción de sodio y de proteína animal. La reducción de sodio en la dieta se acompaña de una caída en la excreción de cistina, las bases para este efecto no se conocen bien ya que el cotrasportador de cistina en el tubo proximal no es dependiente de sodio.
La restricción de proteínas favorece la alcalinización de la orina y aumenta la solubilidad de la cistina y reduce la ingestión de la metionina que es el precursor de la cistina y por tanto reduce su excreción urinaria. Los tratamientos farmacológicos son dos, alcalinización de la orina con citrato o bicarbonato. Debido a que la cistina es un dímero de la cisteína unida por un puente disulfuro (Tioles), la d-pencilamina o la tropónina rompen este puente y hacen más soluble el complejo monomérico de la cisteína. El Captopril que también es un tiol no debe ser usado ya que no alcanza suficientemente a la concentración en la orina para producir un cambio en la solubilidad de la cistina.
Los tioles son compuestos mal tolerados y con muchos efectos indeseables. La troponina es mejor tolerada que la D-penicilina, pero aun así sus reacciones no deseadas son muy frecuentes.
Otras drogas que solo se han usado experimentalmente son el L-dimeti-ester de la cistina que aumenta la solubilidad de la cistina in vitro e in vivo. Funciona en concentraciones pequeñas, sin embargo, tiene efectos adversos, el más notable es la acumulación lisosomal de cistina que recuerda a la Cistinosis; este problema solo se ha descrito en animales de laboratorio y con dosis alta de este compuesto que nunca se ha empleado en seres humanos.52-54
Cálculo coraliforme o de estruvita
Se trata de cálculos de fosfato, amonio y magnesio condicionados por la presencia de infección recurrente de las vías urinarias por proteus species. La ureasa de estos gérmenes descompone la urea en NH3 y CO2; el NH3 se hidroliza en NH4 e incrementa el pH urinario a 8-9. En esta orina alcalina, el CO2 se hidrata a H2CO3 que se disocia en CO3-2 para formar CaCO3. El NH4 precipita PO43 y Mg++ para formar la sal de MgNH4PO4 (fosfato amonio y magnesio) conocida como estruvita. Este tipo de cristal solo aparece en la orina en presencia de infección por proteus, pero también se asocia a otros gérmenes ureasa positivos como klebsiella, otros proteus, alguna variedad de E coli y estafilococo.47,57
Habitualmente, estos enfermos cursan con infección crónica de las vías urinarias, uropatía obstructiva, múltiples cirugías e instrumentación repetida de las vías urinarias. Los cristales de estruvita en el sedimento urinario tienen forma de cajas de muerto que se precipitan y forma grandes cálculos coraliformes siempre infectados. (Figura 9)
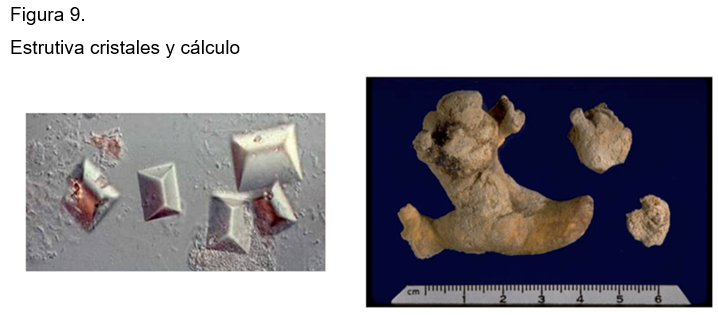
El único fármaco aprobado es el ácido acetohidroxámico que inhibe la ureasa y la cascada de eventos que dan lugar a la SS de los precursores de la estruvita. Los procedimientos invasivos que acompañan, preceden o se siguen a este tratamiento, además del control de la infección con antibióticos o antisépticos urinarios para mantener las cuentas bacterianas bajas y si es posible libres de bacterias ureasa positivos. Para la remoción del cálculo, se utiliza la pielolitotomía percutánea, litotripsia o las dos.
El propósito es extraer de forma completa el cálculo, ya que dejar restos perpetúa la infección puesto que los gérmenes están alojadoss en el interior de la piedra donde no los alcanzan los antibacterianos, además son el nido de otro cálculo. La cirugía a cielo abierto rara vez se requiere. La irrigación posquirúrgica con hemiacidrina ayuda a la lisis progresiva de los cálculos remanentes y puede reducir la recurrencia, a pesar de esto, no es una medida aconsejable por sus efectos indeseables. Hay series que informan recurrencias tan bajas como 10 % y otras de 50 %, a pesar de que la cirugía haya sido muy exitosa y no haya dejado restos de piedras.
EL ácido acetohdroxámico es un inhibidor irreversible de la ureasa y tiene un gran parecido a la estructura química de la urea. Trabaja en forma sinérgica con los antibióticos.58 Se presenta en cápsulas de 250 mg, en adultos es 3-4 cápsulas por día (10-15 m/Kg por dia) y en niños 10 mg/Kg/día. Debe tomarse una hora antes de los alimentos, evitarse en pacientes con creatininas >2 mg/dl. Se debe vigilar la citología hemática cada dos semanas y cuenta de reticulocitos cada tres meses. Tiene una elevada toxicidad y produce temblor, tromboflebitis, anemia hemolítica, depleción de la medula ósea, hepatotoxicidad y trastornos psiquiátricos. Debido a que el tratamiento debe ser prolongado, su uso ha sido muy limitado y con muchas precauciones.
Sin alteraciones metabólicas
De entre 10 y 15 % de los pacientes se caracterizan por formar cálculos de calcio (oxalato y fosfato) sin presentar en el estudio metabólico de litiasis ninguna alteración. Pueden cursar con síntomas asociados tales como volúmenes urinarios bajos y otros factores nutricionales y ambientales. Se les debe recomendar una buena hidratación con la ingestión de 2 o más litros al día, sobre todo en épocas de calor o si viven en zonas de climas cálidos. En pacientes metabólicamente activos o con recaídas se recomienda la administración de citrato de potasio y de tiazidas, aunadas a la hidratación. Además, se pueden añadir alopurinol y fosfatos en casos rebeldes. Aconsejar perder peso si hay sobrepeso u obesidad, reducir la sal, las proteínas animales y los alimentos ricos en oxalatos.47
Resumen del tratamiento de todas las litiasis
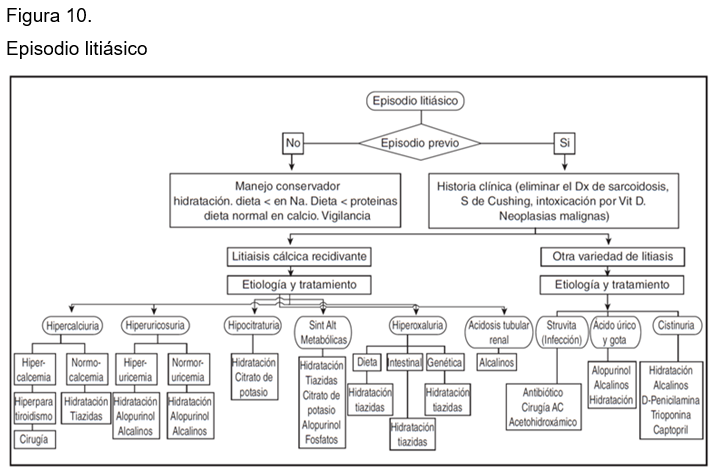
En un capítulo publicado por Peña y Sainz en Nefromecum,47 en un algoritmo, se resumen todas las etiologías de las diversas causas de litiasis y sus tratamientos. (Figura 10)
- Scales CD Jr, Smith AC, Hanley JM, Saigal CS. Urologic diseases in America Project: Prevalence of kidney stones in the United States, Eur Urol. 2012;62:160-
- Scales CD Jr, Tasian GE, Schwaderer AL, et al. Urinary Stone Disorder Disease: Advancing Knowledge, patient Care, and population Health. Clin J Am Soc Npehrol. 2017;11:1305-12.
- Todd Alexander, Brenda R. Hemmelgarn, et al. Alberta Kidney Disease NetworkKidney Stones and Cardiovascular Events: A Cohort Study. Clin J Am Soc Nephrol. 2014;9:506-12.
- Alexander RT, Hemmelgarn BR, Wiebe N, et al. Alberta Kidney Disease Network: Kidney stones and kidney function loss: A cohort study. British Medical J. 2012;345: 5287.
- Rule AD, Roger VL, Melton LJ 3rd, et al. Kidney stones associated with increased risk for myocardial infarction. J Am Soc Nephrol. 2010;21:1641-4.
- Obligado SH, Goldfarb DS. The association of nephrolithiasis with hypertension and obesity: A review. Am J Hypertens. 2008;21:257-64.
- Rule AD, Bergstralh EJ, Melton LJ, et al. Kidney stones and the risk for chronic kidney disease. Clin J Am Soc Nephrol. 2009;4:804-11.
- Aydin H, Yencilek F, Erihan IB, et al. Increased 10-year cardiovascular disease and mortality risk scores in asymptomatic patients with calcium oxalate urolithiasis. Urol Res. 2011;39:451–
- Reiner AP, Kahn A, Eisner BH, et al. Kidney stones and subclinical atherosclerosis in young adults: The CARDIA study. J Urol. 2011;185:920-
- Taylor EN, Stampfer MJ, Curhan GC. Diabetes mellitus and the risk of nephrolithiasis.Kidney Int. 2005;68:1230-5.
- Taylor EN, Stampfer MJ, Curhan GC. Obesity, weight gain and the risk of kidney stones. JAMA. 2005;293:455-
- Ahmed MH, Ahmed HT, Khali AA. Renal stone disease and obesity: what is important for urologists and nephrologist? Renal Failure. 2012;34:1348-54.
- Dellabella M, Milanese G, Muzzonigro G. Medical-expulsive therapy for distal ureterolithiasis: randomized prospective study on role of corticosteroids used in combination with tamsulosin-simplified treatment regimen and health-related quality of life. Urology. 2005;66:712-5.
- Parsons JK, Hergan LA, Sakamoto K, et al. Efficacy of alpha-blockers for the treatment of ureteral stones. J Urol. 2007;177:983–
- Preminger GM, Tiselius HG, Assimos DG, et al. 2007 guideline for the management of ureteral calculi. J Urol. 2007;178:2418–
- Rule AD, Lieske JC, Li X, et al. The RISKS nomogram for predicting a second symptomatic stone episode. J Am Soc Nephrol. 2014;25:2878–86.
- Eisner BH, Goldfarb DS.A Nomogram for the Prediction of Kidney Stone Recurrence. JASN.2014;25:2685-7.
- Borghi L, Meschi T, Amato F, et al. Urinary volume, water and recurrences in idiopathic calcium nephrolithiasis: A 5-year randomized prospective study. J Urol.1996;155:839-43.
- Borghi L, Schianchi T, Meschi T, et al. Comparison of two diets for the prevention of recurrent stones in idiopathic hypercalciuria. N Engl J Med. 2002;346:77-84.
- Peña JC, Fishleder S, Galvan P, Herrera Acosta J. Bases fisicoquímicas de la formación de cálculos de oxalato de calcio. Medición del grado de saturación urinaria por medio del cociente de los productos de actividad. Rev Inv Clin.1981;33:333-
- Coe FJ, Evan A, Worcester E. Pathophysiology-Based Treatment of idiopathic Calcium stones. Clin J Amer Soc Nephrol. 2011;6:2083-
- Renkema KY, Bindels RJM, Hoenderop JGJ. Role of Calcium-Sensing receptor in reducing risk for calcium stones. Clin J Amer Soc Nephrol. 2011;6:2076-
- Ettinger B, Citron JT, Livermore B et al. Chlorthalidone reduces calcium oxalate calculous recurrence but magnesium hydroxide does not. J Urol. 1988;139:679-
- Ohkawa M, Tokunaga S, Nakashima T, et al. Thiazide treatment for calcium urolithiasis in patients with idiopathic hypercalciuria. Br J Urol. 1992;69:571-
- Peña JC, Monforte F, Briceño A. The role of oxalate and formation product ratio in patients with renal stones before and during treatment. J Urol. 1987;138:1137-40.
- Borghi L, Meschi T, Guerra A, et al. Randomized prospective study of a nonthiazide diuretic, indapamide, in preventing calcium stone recurrences. J Cardiovasc Pharmacol. 1993;22(Suppl 6):S78–S86.
- Yendt ER, Guay GF, Garcia DA. The use of thiazides in the prevention of renal calculi.J Am Med Assoc. 1970;102:614–
- Pak Etiology and treatment of urolithiasis. Am J Kidney Dis. 1991;18:624-37.
- Coe FL, Favus MJ, Pak CY, et al. Hyperuricosuric calcium stone disease and mixed stones. In: Kidney Stones: Medical and Surgical Management, edited by Coe FL, Favus MJ, Pak CY, Parks JH, Preminger GM Philadelphia. Lippincott-Raven. 1996;851–858.
- Pak CY, Fuller C, Sakhaee K. Long-term treatment of calcium nephrolithiasis with potassium citrate. J Urol. 1985;134(1):11-19.
- Barcelo P, Wuhl O, Servitge E, et al. Randomized double-blind study of potassium citrate in idiopathic hypocitraturic calcium nephrolithiasis. J Urol. 1993;150(6):1761-4.
- Reddy ST, Wang CY, Sakhaee K. Effect of low-carbohydrate high-protein diets on acid-base balance, stone-forming propensity, and calcium metabolism. Am J Kidney Dis. 2002;40(2):265-74
- Welch BJ, Graybeal D, Moe OW, et al. Biochemical and stone-risk profiles with topiramate treatment. Am J Kidney Dis. 2006;48(4):555-63.
- Seltzer MA, Low RK, McDonald M. Dietary manipulation with lemonade to treat hypocitraturic calcium nephrolithiasis. J Urol. 1996;156(3):907-9.
- Coe FL. Treated and untreated recurrent calcium nephrolithiasis in patients with idiopathic hypercalciuria, hyperuricosuria, or no metabolic disorder. Ann Intern Med. 1977;87:404-
- Ryall RL, Grover PK, Marshall VR. Urate and calcium stones: Picking up a drop of mercury with one’s fingers?. Am J Kidney Dis. 1991;17:426-30.
- Grover PK, Marshall VR, Ryall RL. Dissolved urate salts out Calcium oxalate in undiluted human urine in vitro: Implications for calcium oxalate stone genesis. Chem Biol. 2003;10:271-8.
- Curhan GC, Taylor EN. 24-h uric acid excretion and the risk of kidney stones. Kidney Int. 2008;73:489-96.
- Ettinger B, Tang A, Citron JT, et al. Randomized trial of allopurinol in the prevention of calcium oxalate calculi. N Engl J Med. 1986;315: 1386–9.
- Ettinger B. Does hyperuricosuria play a role in calcium oxalate lithiasis?. J Urol. 1989;141:738-41.
- Mayer MD, Khosravan R, Vernillet L, et al. Pharmacokinetics and pharmacodynamics of febuxostat, a new non-purine selective inhibitor of xanthine oxidase in subjects with renal impairment. Am J Ther. 2005;12:22-34.
- Becker MA, Schumacher HR Jr, Wortmann RL, et al. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N Engl J Med. 2005;353:2450-61.
- Goldfarb DS, MacDonald PA, Gunawardhana LH, et al. Randomized control trial of Febuxostat versus Allopurinol in individuals with higher uric acid excretion and calcium stones. Clin J Amer Soc Nephro.l 2013;8:1960-
- von Unruh GE, Voss S,Sauerbruch T,et al. Dependence of Oxalate Absorption on the Daily Calcium Intake. JASN. 2004;15:1567-
- Coe FL, Evan A, Worcester E. Kidney stone disease. J. Clin Invest. 2005;115:2598-608.
- Kaufman DW,Kelly JP,Curhan GC, et al. Oxalobacter formigenes may reduce the risk of Calcium Oxalate Kidney Stones. J Am Soc Nephrol. 2008;19:1197–203.
- Peña JC, Saenz S. Manejo Farmacológico de la Nefrolitiasis. NEFROMECUM. Editores: Correa-Rotter R, Niño Cruz JA. Publicaciones Permanyer, Barcelona España. 2009;9:105-
- Chillaron J, Font-Llitjos M, Fort J, et al. Pathophysiology and treatment of cystinuria. Nat Rev Nephrol. 2010;6:424–34.
- Mattoo A, Goldfarb DS: Cystinuria. Semin Nephrol. 2008;28:181–91.
- Goldfarb DS, Coe FL, Asplin JR. Urinary cystine excretion and capacity in patients with cystinuria. Kidney Int. 2006;69:1041–7.
- Goldfarb DS. Potential pharmacological treatment for Cystinuria and for calcium stones associated with hyperuricosuria. Clin J Amer Soc Nephrol. 2011;6:2093.
- Crawhall JC, Scowen EF, Watts RW. Effect of penicillamine on cystinuria. Br Med J. 1963;1:588–59.
- Dahlberg PJ, van den Berg CJ, Kurtz SB, et al. Clinical features and management of cystinuria. Mayo Clin Proc. 1977;52:533–
- Peña JC. Avances y retos en la fisiopatologia y tratamiento de la nefrolitiasis. Acta Medica Grupo Angeles. 2016;14:155-
- Rodriguez LM, Santos F, Malaga S, Martinez V. Effect of a low sodium diet on urinary elimination of cystine in cystinuric children. Nephron. 1995;71:416–8.
- Rodman JS, Blackburn P, Williams JJ, et al. The effect of dietary protein on cystine excretion in patients with cystinuria. Clin Nephrol. 22:273–46.
- Kelly A, Healy MD, Ogan K. Pathophysiology and management of infectious staghorn calculi. Urol Clin N Am. 2007;34:363-74.
- Williams JJ, Rodman JS, Peterson CM. A randomized double blind study of aceohydroxaminic acid in struvite nephrolithiasis. N Engl J Med. 1984;311:760-4.

