Isabel Cristina Cañeda-Guzmán
Universidad Nacional Autónoma de México, Facultad de Medicina, Unidad de Investigación en Medicina Experimental. Ciudad de México, México.
Jaime Zamora-Chimal
Universidad Nacional Autónoma de México, Facultad de Medicina, Unidad de Investigación en Medicina Experimental. Ciudad de México, México.
Edith A. Fernández-Figueroa
Instituto Nacional de Medicina Genómica, Departamento de Genómica Computacional. Ciudad de México, México.
Laura E. Soto-Serna
Universidad Nacional Autónoma de México, Facultad de Medicina, Unidad de Investigación en Medicina Experimental. Ciudad de México, México.
Diego M. Coria-Paredes
Universidad Nacional Autónoma de México, Facultad de Medicina, Unidad de Investigación en Medicina Experimental. Ciudad de México, México.
Ingeborg Becker
Universidad Nacional Autónoma de México, Facultad de Medicina, Unidad de Investigación en Medicina Experimental. Ciudad de México, México.
Introducción
La leishmaniasis es un grupo de enfermedades causadas por más de 20 especies de protozoarios parásitos del género Leishmania. Esta parasitosis se adquiere mediante la picadura de mosquitas hembras pertenecientes a los géneros Phlebotomus, en el viejo mundo, y Lutzomyia en América.1,2 (Figura 1)

Formas clínicas
Las manifestaciones clínicas pueden ser a nivel cutánea: leishmaniasis cutánea localizada (LCL), leishmaniasis cutánea difusa (LCD) y leishmaniasis mucocutánea (LMC); o visceral: leishmaniasis visceral (LV).
La lesión de la LCL se desarrolla durante el primer mes de infección. Puede presentarse con un amplio espectro clínico:
1) Una lesión típica en forma de úlcera que se produce en el sitio de la picadura
2) Lesiones atípicas como placas atróficas, polilesionales, mutilantes, esporotriciformes o coinfectadas con bacterias (Figura 2).
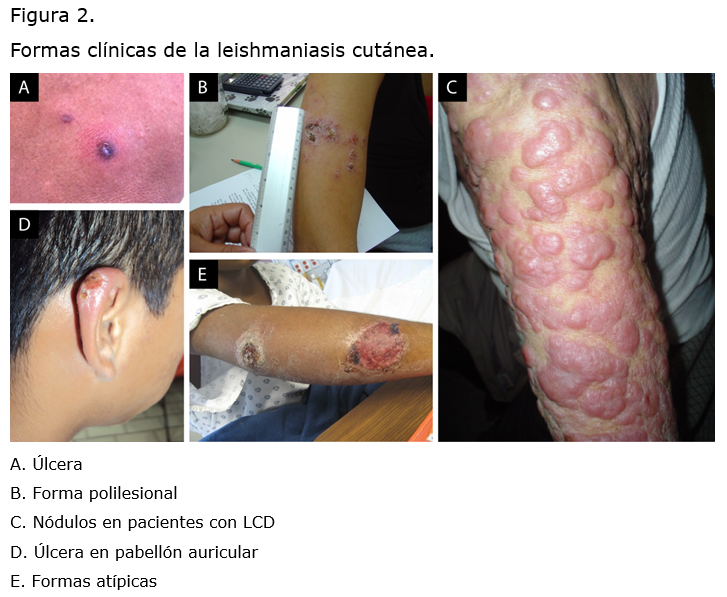
El tamaño de las úlceras generalmente es menor a 1 cm, aunque en casos crónicos pueden tener tamaños mayores a 3 cm. La ubicación de la lesión puede variar según las regiones geográficas, por ejemplo, en la península de Yucatán, México, la lesión más frecuente se localiza en el pabellón auricular (úlcera del chichero), mientras que en Brasil los miembros inferiores son los más afectados y se conocen como úlceras Bauru.3
Entre las formas severas de la leishmaniasis se encuentra la LMC, que tiene tropismo por la región naso-orofaríngea que cursa con una destrucción tisular altamente mutilante. Por otro lado, la LCD se caracteriza por presentar nódulos que afectan a todo el tegumento, muy similares a los de la lepra lepromatosa. La LV o kala-azar, también conocida como fiebre negra, tiene un desarrollo muy heterogéneo pues se presenta en un periodo de 1 a 36 meses después de la picadura del vector infectado. Esta forma clínica se caracteriza por presentar fiebre, anorexia, diarrea, palidez, dolor abdominal, hepato-esplenomegalia y hemorragias orales, nasales o intestinales.3
La infección por Leishmania
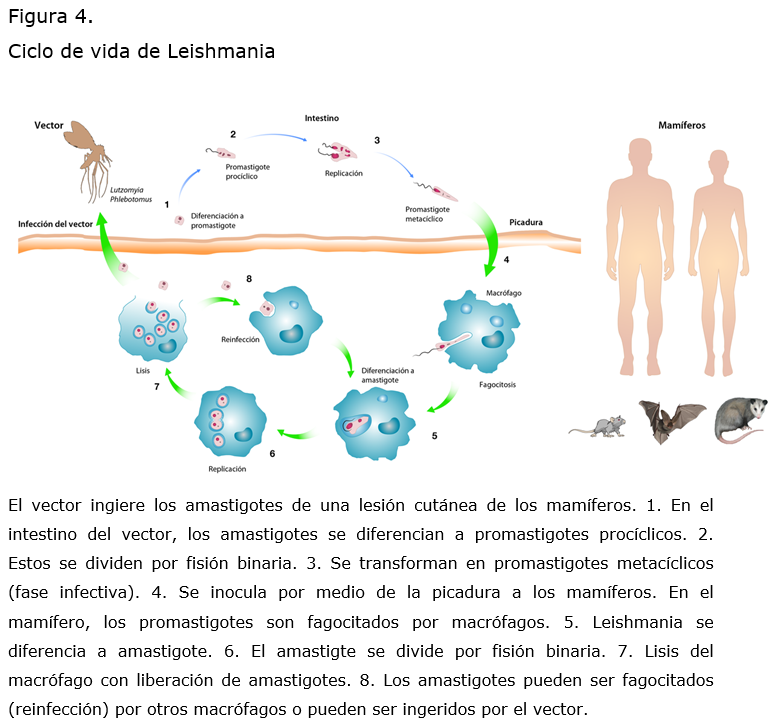
Leishmania tiene un ciclo de vida dimórfico que consiste en promastigotes extracelulares que se multiplican y desarrollan en el tracto digestivo del insecto vector y en amastigotes intracelulares que residen y se multiplican dentro de vacuolas fagolisosomales dentro de las células de mamíferos. El promastigote mide entre 10 y 15 µm, es elongado y posee un flagelo. El amastigote mide de 2 a 4 µm es intracelular y ovoide.4 (Figura 3)

El vector se infecta al ingerir sangre de un hospedero infectado (animales silvestres, domésticos o el ser humano). En su intestino, los amastigotes se transforman a promastigotes, ahí se dividen y pasan por varios estadíos de maduración, llegando a ser infectivos (promastigotes metacíclicos) después de 5 a 7 días. Posteriormente, cuando el vector se alimenta, infecta al humano inoculando a los promastigotes en la dermis donde son reconocidos y fagocitados por diversas células del sistema inmune como macrófagos, células dendríticas y granulocitos.
Dentro de las células fagocíticas, los parásitos se transforman en amastigotes e inician su división celular por fisión binaria hasta lisar a la célula hospedera, de esta forma se liberan los amastigotes que son fagocitados por nuevas células.3,4 (Figura 4)
Respuesta inmune en leishmaniasis
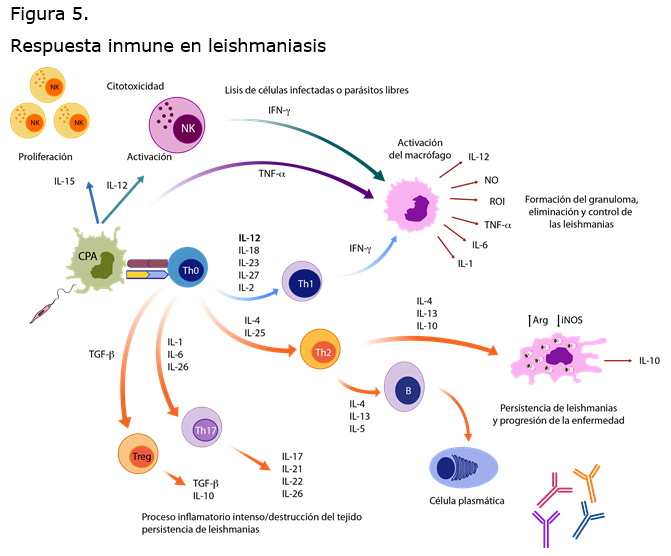
La respuesta inmune inicia con la laceración de la piel por el vector; participan diferentes células, moléculas y receptores. Gran parte de los parásitos no sobreviven a la activación del complemento, ya que al activarse se genera el complejo de ataque a la membrana.
Por otra parte, los parásitos sobrevivientes son opsonizados por C3b y C3bi, facilitando su entrada a las células hospedera.5,6 Durante los primeros días, los neutrófilos son las principales células en el infiltrado inflamatorio que controlan la infección mediante varios mecanismos como fagocitosis, liberación de gránulos (enzimas líticas) y netosis (liberación de su ADN e histonas que atrapan a los parásitos). Posteriormente, estas células mueren por apoptosis y son fagocitadas por macrófagos mediante receptores tipo scavenger, que permiten que el parásito ingrese de manera silenciosa al macrófago (sin activar mecanismos leishmanicidas). A esta estrategia de evasión se le denomina efecto caballo de Troya.6
La primera línea de defensa ejercida por neutrófilos es seguida por la afluencia de macrófagos durante la primera semana de la infección. Los macrófagos son las principales células hospederas de Leishmania que llevan a cabo varias funciones en la leishmaniasis: eliminan al parásito a través de la producción de radicales de oxígeno y nitrógeno, producen citocinas y quimiocinas que inducen, dirigen y activan a las células de la respuesta inmune adaptativa (linfocitos); y presentan antígenos de los parásitos muertos a los linfocitos T para su activación.7,8
Entre las principales citocinas que libera el macrófago se encuentra la IL-12, que participa en la activación de las células NK (natural killer) y en la activación de la respuesta inmune adaptativa Th-1. Las células NK, a su vez, son capaces de reconocer y matar al parásito o a las células infectadas, mediante liberación de gránulos líticos. Otras de las funciones de las células NK es producir citocinas activadoras del macrófago (IFN-g y TNF-a) que incrementan su capacidad leishmanicida.9
Los macrófagos inician la producción de citocinas proinflamatorias (IL-1, TNF-a, IL-12, IL-6, IFN-g), quimiocinas y moléculas coestimuladoras después de reconocer a los patrones moleculares asociados a patógenos (PAMPs) del parásito mediante receptores de reconocimiento de patrones (PRRs). Entre estos receptores se encuentran el TLR2 que reconoce al LPG (lipofosfoglicano), el TLR4, a GPI (glicofosfatidilinositol) y el TLR9, al DNA de Leishmania.10,15.
La respuesta inmune adaptativa contra el parásito es mediada por los linfocitos T y B e inicia entre 4 y 7 días después de la infección. La activación de los linfocitos T CD4 tipo Th1 favorece la resolución de la enfermedad mediante la producción de IFN-g y TNF-a, con la activación de la iNOS (sintasa inducible de óxido nítrico) y la producción de óxido nítrico, uno de los principales mecanismos leishmanicidas, por parte de los macrófagos infectados.
En contraste, una respuesta tipo Th2 lleva a la progresión de la enfermedad por la producción de IL-4 e IL-13, que inducen la producción de anticuerpos involucrados en la persistencia de la infección.5,16 (Figura 5)17
Epidemiología
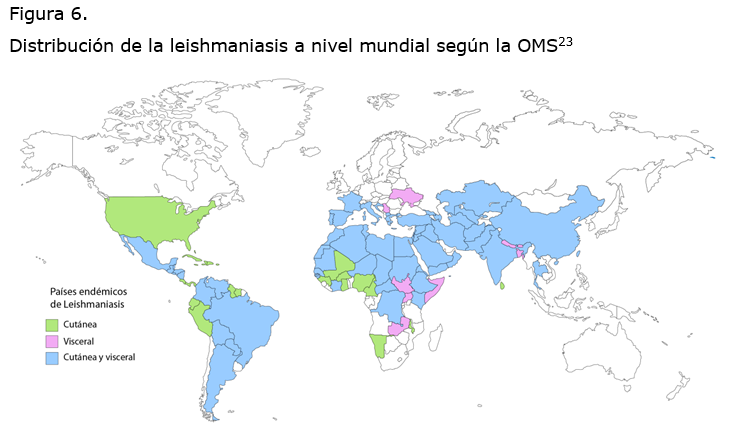
La leishmaniasis es endémica en 98 países, principalmente en áreas tropicales, subtropicales y templadas. El número de casos se incrementa cada año debido tanto a las migraciones hacia estas áreas, como a la presencia de reservorios y vectores, el cambio climático, el turismo, la deforestación, los desastres naturales y los conflictos armados que generan condiciones de hacinamiento en los refugiados. Aunado a los factores ambientales, también participan los del hospedero, tales como el género, la edad, la respuesta inmune y el estado nutricional.18
Actualmente, la Organización Mundial de la Salud (OMS) calcula que 350 millones de personas viven en zonas de riesgo con prevalencia mundial de 12 millones de casos. Cada año se reportan de 0.7 a 1.2 millones de nuevos casos de leishmaniasis cutánea (LC) y de 0.2 a 0.4 millones de con leishmaniasis visceral (LV), con 20 000 a 30 000 defunciones al año. No obstante, de los 98 países afectados hasta 2016, sólo 42 notificaron sus casos de LC a la OMS y 38 países reportaron casos con LV.19
El 90 % de los casos con LC se registran en Brasil, Bolivia, Colombia, Nicaragua, Perú, Afganistán, Sudán y Siria. Las especies responsables de LC en Europa, Asia y África son Leishmania tropica, L. major y L. aethiopica. En el continente americano la LC es producida por especies pertenecientes a los complejos L. (L) mexicana y L. (V) braziliensis.18
En México, Leishmania mexicana es el agente causal de la LC registrada en 22 estados. En el 2016, el Sistema Nacional de Vigilancia Epidemiológica reportó 418 casos, siendo Tabasco, Quintana Roo, Campeche, Chiapas y Veracruz los estados con el mayor número de casos.20 El número de pacientes con LMC es escaso y se han detectado en Veracruz, Chiapas y Oaxaca.21
Las especies causantes de LV son L. donovani y L. infantum y 90 % de estos casos se encuentran en la India, Bangladesh, Nepal, Sudán, Etiopía y Brasil. El 70 % de los pacientes inmunosuprimidos infectados por VIH pueden desarrollar esta forma clínica. Adicionalmente, se han registrado infecciones posteriores a transplantes de órganos.18,22 (Figura 6)
Reservorios y vectores en la leishmaniasis
El ciclo natural de Leishmania abarca diversos hospederos que incluyen reservorios (mamíferos) y vectores. Hasta el momento, se han registrado marsupiales, perezosos, armadillos, roedores, monos y murciélagos como reservorios infectados naturalmente con diferentes especies de Leishmania.24 Sin embargo, no todos los hospederos presentan signos de la infección, lo cual refleja una interacción antigua entre hospedero-parásito. En México se han registrado algunas especies de roedores, murciélagos y monos infectados naturalmente.25
Uno de los reservorios domésticos es el perro. La leishmaniasis canina generalmente es muy severa, presentando frecuentemente lesiones en piel, ojos, onicogrifosis, linfadenomegalias, caquexia y epistaxis. En algunas ocasiones los perros pueden presentar abundantes amastigotes en la dermis y en vísceras.24
Los vectores de Leishmania son pequeños dípteros que se desarrollan en sitios ricos de materia orgánica como los cultivos de café, cacao, plátano y caña, donde las larvas pueden alimentarse del abundante detrito orgánico. El promedio de vida de un adulto es de 25 a 30 días.26 Los adultos son frágiles, midiendo alrededor de 5 mm, sus cuerpos y alas tienen abundantes pilosidades, parecidas a una polilla, y tienen patas largas. Las alas son lanceoladas, la cabeza y ojos son redondos y poseen antenas largas. La hembra es hematófaga y tiene un aparato bucal muy desarrollado, es corto y conformado por seis estiletes aserrados con lo que cortan la piel. (Figura 7)

Las hembras necesitan de la ingestión sanguínea para el desarrollo de sus huevos. Las mordeduras de estos insectos únicamente se llevan a cabo en la piel expuesta, debido al pequeño tamaño del aparato bucal. Los sitios más predilectos son cara, pabellón auricular, cuello, brazos y piernas.
Al insertar las partes bucales en la piel producen una herida en los capilares generando una “charca” de sangre. El tiempo que requiere el vector en madurar para poder transmitir parásitos infectivos es de 1 a 3 semanas, dependiendo de las condiciones climáticas.26
La mayor actividad de los flebotominos es crepuscular, son atraídos por la luz. Su vuelo es corto y silencioso y localizan a sus hospederos principalmente al detectar el calor del cuerpo, seguido de señales olfatorias y visuales. Leishmania manipula la conducta de los flebotominos, ya que las moscas que están infectadas realizan un mayor número de picaduras a múltiples hospederos en comparación con moscas no infectadas.27 No obstante, hay una preferencia por alimentarse de las lesiones. La mordedura de un flebotomino se caracteriza por presentar un punto central y puede ser dolorosa y pruriginosa.
En México se han registrado 11 especies antropofílicas de flebotominos infectadas naturalmente con Leishmania mexicana, siendo las especies más prevalentes: Lutzomyia olmeca, Lu. cruciata, Lu. shannoni, Lu. panamensis y Lu. Longipalpis.25
Diagnóstico y tratamiento
El diagnóstico se basa en datos clínicos, epidemiológicos y de laboratorio. De manera directa, los parásitos pueden ser identificados en improntas teñidas con Giemsa o en cortes histológicos de biopsias en lesiones del paciente.28
Los métodos serológicos permiten detectar la exposición al parásito, sin embargo, son de baja especificidad con riesgo a presentar reacciones cruzadas con Trypanosoma cruzi, ya que ambos comparten muchas determinantes antigénicas. Los métodos moleculares como la PCR punto final y tiempo real representan técnicas con mayor sensibilidad y especificidad para determinar el género, la especie e incluso la carga parasitaria. Conocer la especie de Leishmania que infecta es importante para aplicar el tratamiento adecuado, seguir el curso natural de la enfermedad y determinar si existe resistencia al tratamiento.29,30
El tratamiento depende de diversos factores que incluyen el cuadro clínico y la especie del parásito.31 La mayoría de los tratamientos utilizados para cualquier forma clínica pueden ser tóxicos y en algunos casos existe resistencia al medicamento.32 Es común el uso de antimoniales pentavalentes por vía sistémica (Sb5+) en sus formas de estibogluconato de sodio (Pentostam) o antimoniato de meglumina (Glucantime).
En América, se aplican 20 mg de SB5+/kg de peso durante 20 días por vía intramuscular. También existen tratamientos intralesionales como primera línea terapéutica en lesiones localizadas causadas por L. major, L. tropica, L. panamensis y L. mexicana.33
Los efectos adversos a algunos medicamentos son irritación local, anorexia, mialgia, artralgia, incremento en enzimas hepáticas, urea y creatinina; además de alteraciones electrocardiográficas. Existen otras estrategias de tratamiento, incluyendo Anfotericina B, Paramomicina, Miltefosina y Sitamaquina, que han mostrado ser eficaces contra Leishmania, aunque también pueden generar efectos adversos. En el caso de miltefosina por vía oral se ha observado toxicidad gastrointestinal, por lo que está introduciéndose la formulación tópica para piel.31-33
Desarrollo de vacunas en leishmaniasis
Hasta el momento no hay una vacuna contra la leishmaniasis en humanos. Se han realizado ensayos utilizando parásitos muertos o atenuados, un proceso conocido como leishmanización, que no ha sido eficaz para todas las especies de Leishmania. También se han utilizado fragmentos del parásito o proteínas recombinantes, junto a adyuvantes. En la última década se implementó el uso de ADN plasmídico para favorecer una respuesta protectora tipo Th1.
En la tabla 1, se muestra un listado de antígenos que inducen protección contra Leishmania.34 Aunque aun no existen vacunas para humanos, sí existen para la leishmaniasis visceral canina causada por L. infantum (Leishmune®, Leish-Tec® y CaniLeish®).35
| Tabla 1.
Antígenos propuestos como vacunas contra diferentes especies de Leishmania que han inducido protección |
||||
| Antígeno | Modelo
animal |
Especie
(FC) |
Resultado | Tipo de respuesta inmune desencadenada |
| Proteína recombinante
rA2 |
BALB/c | L. chagasi
(LV)
|
Protección | Alta producción de IFN-γ, aumento de citotoxicidad por T CD8 baja respuesta de anticuerpos.
|
| Promastigotes de L. mexicana deficientes en cisteína proteinasa
|
Hámster | L. mexicana
(LC)
|
Protección | Alta producción de IFN-γ, sin diferencia en la producción de IL-10, sin embargo, no se observó TGF-β, IL-4 y no se detectó IL-12 p40.
|
| Proteína recombinante
Protein Q |
Perro | L. infantum
(LV)
|
Protección | 90 % de protección, hipersensibilidad retardada positiva.
|
| Proteína recombinante
TSA+LmSTI1 No
|
Mono | L. major
(LC)
|
Protección | No se observó desarrollo de lesiones, incluso con reexposición después de 4 meses del primer desafío. |
| Proteína recombinante
TSA+LmSTI1 + LeIF+Lbhsp83 GM-CSF |
Humano | L. braziliensis
(LMC) |
Protección | 83 % de los pacientes mostraron remisión clínica completa después de 9 meses, todos fueron CC después de 5 años de seguimiento.
|
| a FC: forma clínica. LC: leishmaniasis cutánea; LV: leishmaniasis visceral; LMC: leishmaniasis mucocutánea. | ||||
Medidas de control y prevención
La primera línea de defensa es evitar ser mordido por los flebotominos, utilizando repelentes y ropa protectora, además del uso de insecticidas en mosquiteros y fumigaciones en interiores.33
Referencias:
- Akhoundi M, Kuhls K, Cannet A, et al. A Historical Overview of the Classification, Evolution, and Dispersion of Leishmania Parasites and Sandflies. PLoS Negl Trop Dis. 2016;10(3):e0004349. doi: 10.1371/journal.pntd.0004349.
- OMS. Informe de una reunión del Comité de Expertos de la OMS sobre el Control de las Leishmaniasis. Serie de Informes Técnicos 949. Ginebra, 2010.
- Lupi O, Bartlett BL, Haugen RN, et al. Tropical dermatology: Tropical diseases caused by protozoa. J Am Acad Dermatol. 2009;60(6):897‑925.
- Bates PA, Rogers ME. New insights into the developmental biology and transmission mechanisms of Leishmania. Curr Mol Med. 2004;4(6):601-9.
- Gurung P, Kanneganti TD. Innate immunity against Leishmania infections. Cell Microbiol. 2015;17(9):1286–94.
- Ribeiro-Gomes FL, Sacks D. The influence of early neutrophil Leishmania interactions on the host immune response to infection. Front Cell Infect Microbiol. 2012;4(2):1–8.
- Ribeiro-Gomes FL, Peters N, Debrabant A, Sacks D. Efficient capture of infected neutrophils by dendritic cells in the skin inhibits the early anti-leishmania response. PLoS Pathog. 2012;8(2):e1002536.
- Twigg HL 3rd. Macrophages in innate and acquired immunity. Semin Respir Crit Care Med. 2004; 25(1): 21–31.
- Bogdan C. Natural killer cells in experimental and human leishmaniasis. Front Cell Infect Microbiol. 2012;2:69. doi: 10.3389/fcimb.2012.00069.
- Aebischer T, Bennett L, Pelizzola M, et al. A critical role for lipophosphoglycan in proinflammatory responses of dendritic cells to Leishmania mexicana. Eur J Immunol. 2005;35(2):476–86.
- Abou Fakher FH, Rachinel N, Klimczak M, et al. TLR9-dependent activation of dendritic cells by DNA from Leishmania major favors Th1 cell development and the resolution of lesions. J Immunol. 2009;182(3):1386–96.
- Tuon FF, Amato VS, Bacha HA, et al. Toll-Like Receptors and Leishmaniasis. Infect Immun. 2008;76(3):866-72.
- Zamora-Chimal J, Fernández-Figueroa EA, et al. NKT cell activation by Leishmania mexicana LPG: Description of a novel pathway. Immunobiology. 2017;222(2):454-62. doi: 10.1016/j.imbio.2016.08.003.
- Becker I, Salaiza N, Aguirre M, et al. Leishmania lipophosphoglycan (LPG) activates NK cells through toll-like receptor-2. Mol Biochem Parasitol. 2003;130(2):65-74.
- Cañeda-Guzmán IC, Salaiza-Suazo N, Fernández-Figueroa EA, et al. NK cell activity differs between patients with localized and diffuse cutaneous leishmaniasis infected with Leishmania mexicana: a comparative study of TLRs and cytokines. PLoS One. 2014;9(11):e112410.
- Tacchini-Cottier F, Weinkopff T, Launois P. Does T Helper Differentiation Correlate with Resistance or Susceptibility to Infection with L. major? Some Insights From the Murine Model. Front Immunol. 2012;3:1–9. Doi: 10.3389/fimmu.2012.00032. eCollection 2012.
- Pedraza-Zamora CP, Delgado-Domínguez J, Zamora-Chimal J, Becker I. Th17 cells and neutrophils: Close collaborators in chronic Leishmania mexicana infections leading to disease severity. Parasite Immunol. 2017;39(4). doi: 10.1111/pim.12420.
- Alvar J, Vélez ID, Bern C, et al. Leishmaniasis Worldwide and Global Estimates of its Incidence. PLoS ONE. 2012;7(5):e35671.
- World Health Organization (WHO). Global Health Observatory (GHO). Leishmaniasis: Situation and trends. 2018 Disponible en: http://www.who.int/gho/neglected_diseases/leishmaniasis/en/.
- Dirección General de Epidemiología. Boletín Epidemiológico Sistema Nacional de Vigilancia Epidemiológica Sistema Único de Información. 2018. Disponible en: https://www.gob.mx/salud/acciones-y-programas/direccion-general-de-epidemiologia-boletin-epidemiologico.
- Velasco-Castrejon O, Savarino S, Neva F, Guzman-Bracho C. Los agentes etiológicos de las leishmaniasis cutáneas en México. Presencia de L. braziliensis en Mexico. Rev Lat Amer Microbiol. 1989;31:231-34.
- Jiménez-Marco T, Fisa R, Girona-Llobera E, et al. Transfusion-transmitted leishmaniasis: a practical review. Transfusion. 2016;56:45‑51.
- World Health Organization (WHO). Global Health Observatory (GHO). Data repository: Neglected tropical diseases, Leishmaniasis. 2016. Disponible en: http://apps.who.int/gho/data/node.main.NTDLEISH?lang=en.
- Roque AL, Jansen AM. Wild and synanthropic reservoirs of Leishmania species in the Americas. Int J Parasitol Parasites Wildl. 2014;3(3):251‑62.
- González-Salazar C, Stephens C. Constructing ecological networks: a tool to infer risk of transmission and dispersal of leishmaniasis. Zoonoses Public Health. 2012;59(2):179-93.
- Ready PD. Biology of phlebotomine sand flies as vectors of disease agents. Annu Rev Entomol. 2013;58:227-50.
- Bates PA, Depaquit J, Galati EA, et al. Recent advances in phlebotomine sand fly research related to leishmaniasis control. Parasit Vectors. 2015;8:131.
- CDC Laboratory. Practical Guide for specimen collection and reference diagnosis of leishmaniasis. 2016. Disponible en: https://www.cdc.gov/parasites/leishmaniasis/resources/pdf/cdc_-diagnosis_guide_leishmaniasis_2015.pdf.
- Kobets T, Grekov I, Lipoldova M. Leishmaniasis: Prevention, Parasite Detection and Treatment. Curr Med Chem. 2012;19(10):1443–74.
- Moreira OC, Yadon ZE, Cupolillo E. The Applicability of Real-Time PCR in the Diagnostic of Cutaneous Leishmaniasis and Parasite Quantification for Clinical Management: Current Status and Perspectives. Acta Trop. 2017. Doi: doi.org/10.1016/j.actatropica.2017.09.020.
- World Health Organization (WHO). Media centre. Leishmaniasis. 2017. Disponible en: http://www.who.int/mediacentre/factsheets/fs375/en/.
- Croft SL, Sundar S, Fairlamb AH. Drug Resistance in Leishmaniasis. Clin Microbiol Rev. 2006;19(1):111-126. doi: 10.1128/CMR.19.1.111-126.2006.
- Torres-Guerrero E, Quintanilla-Cedillo MR, Ruiz-Esmenjaud J, Arenas R. Leishmaniasis: a review. F1000Res. 2017;6:750.
- Nagill R, Kaur S. Vaccine candidates for leishmaniasis: A review. Int Immunopharmacol. 2011;11(10):1464–88.
- Gradoni L. Canine Leishmania vaccines: Still a long way to go. Vet Parasitol. 2015;208(1-2):94-100.
