Paz María Salazar-Schettino
Universidad Nacional Autónoma de México, Facultad de Medicina, Departamento de Microbiología y Parasitología. Ciudad de México, México.
Correspondencia: [email protected]
Teléfono: 5623-2468
Martha Irene Bucio-Torres
Universidad Nacional Autónoma de México, Facultad de Medicina, Departamento de Microbiología y Parasitología. Ciudad de México, México.
Margarita Cabrera-Bravo
Universidad Nacional Autónoma de México, Facultad de Medicina, Departamento de Microbiología y Parasitología. Ciudad de México, México.
Julieta Rojo-Medina
Secretaría de Salud, Centro Nacional de la Transfusión Sanguínea. Ciudad de México, México.
Introducción
La tripanosomiasis americana o enfermedad de Chagas es una parasitosis cuyo agente causal es Trypanosoma cruzi; este protozoario flagelado en la naturaleza se transmite al hombre por insectos hematófagos llamados triatóminos, que pueden colonizar la vivienda; es una zoonosis compleja, debido a que en la naturaleza, existe interacción entre varias especies del transmisor y mamíferos reservorios, incluido el humano.
Esta entidad clínica es la enfermedad parasitaria con mayor carga económica en América Latina y se ubica dentro de las enfermedades olvidadas o desatendidas que afectan a poblaciones pobres con limitado acceso a los servicios de salud, especialmente en áreas rurales y en zonas marginales.
El médico Carlos Chagas, en 1909, además de describir la mayoría de las características clínicas de la enfermedad en el humano y animales de laboratorio en Brasil, también caracterizó a Trypanosoma cruzi, el cual aísla Panstrongylus megistus; señaló el principal mecanismo de transmisión de la infección por la inoculación transcutánea del parásito presente en las excretas infectadas de insectos hematófagos y describió el primer caso en una niña de dos años que murió a los 82 años sin patología compatible con la enfermedad.1
En el mundo existen más de 150 especies de la subfamilia Triatominae, que transmiten la infección a los seres humanos y a más de 100 especies de mamíferos domésticos y silvestres; de los 15 géneros relacionados con la transmisión al humano, los de mayor importancia son Triatoma, Panstrongylus y Rhodnius; se localizan en grietas de las paredes y techos de viviendas en zonas endémicas.
Las condiciones de pobreza y hacinamiento, como fue señalado desde 1909 por Chagas en Brasil y Mazza en Argentina, aún prevalecen en Latinoamérica y propician la colonización y dispersión del transmisor que se localiza desde el sur de Estados Unidos hasta el sur de Argentina y Chile.
La Organización Mundial de la Salud (OMS) en 2015, calculó 5 742 167 personas infectadas con T. cruzi con una incidencia anual de 29 925 casos en Latinoamérica donde se considera endémica en 21 países (Argentina, Brasil, Chile, Uruguay, Paraguay, Perú, Ecuador, Bolivia, Venezuela, Colombia, Guyana Francesa, Guyana, Surinam, Costa Rica, El Salvador, Honduras, Nicaragua, Panamá, Belice, Guatemala y México).
Los movimientos poblacionales han modificado la distribución de esta enfermedad y la han convertido en un riesgo mundial, especialmente por la vía transfusional en bancos de sangre donde los índices de contaminación varían entre 3 y 53 %; actualmente se le considera emergente en países no endémicos como son Estados Unidos, Canadá, Australia, Japón, Francia, España, Bélgica, Portugal, Suiza, Gran Bretaña, Irlanda del Norte, Italia, Alemania, Austria, Croacia, Dinamarca, Luxemburgo, Noruega, los Países Bajos, Rumania y Suecia.2,5
México es un país endémico para la enfermedad de Chagas, la OMS en 2015, calculó 876 458 personas infectadas con T. cruzi y 6 135 casos nuevos anuales por transmisión vectorial; México se ubica después de Argentina y Brasil, como el tercer país con mayor prevalencia y después de Bolivia con el mayor número de casos nuevos.2
En México, dos terceras partes del territorio tienen las condiciones para que se lleve a cabo la transmisión vectorial con 32 especies de triatóminos. Las poblaciones vectoriales, por su capacidad de convivencia con el humano, se consideran domiciliadas, peridomiciliadas y selváticas o silvestres; en nuestro país, se han reportado 13 especies relacionadas con la transmisión vectorial dentro del domicilio, dos de ellas domiciliadas: Triatoma barberi, asociada a la presencia de miocardiopatías y megas de órganos del tracto digestivo en Colima, Guanajuato, Guerrero, Hidalgo, Jalisco, Michoacán, Morelos, Oaxaca, Puebla, Querétaro, Tlaxcala y Veracruz; y Triatoma dimidiata, distribuida desde los países andinos y de Centroamérica hasta México, asociada a cardiopatías en los estados de Campeche, Colima, Chiapas, Estado de México, Guanajuato, Guerrero, Hidalgo, Jalisco, Nayarit, Oaxaca, Puebla, Quintana Roo, San Luis Potosí, Tabasco, Veracruz y Yucatán. Las otras 11 especies son peridomiciliadas dentro de las cuales, las de mayor importancia pertenecen al complejo phyllosoma además de Triatoma longipennis.6,7
Mecanismos de transmisión y ciclo biológico
Natural, vectorial o rural
En el mundo, las especies de vectores pertenecen a tres géneros de importancia médica: Triatoma, Rhodnius y Panstrongylus; distribuidos desde el sur de Estados Unidos hasta el sur de Argentina y Chile.8 En México, de las 32 especies reportadas, trece se relacionan con la transmisión al humano, dos intradomiciliadas (T. barberi y T. dimidiata) y once peridomiciliadas.7 Actualmente, Rhodnius prolixus se considera eliminado en nuestro país.9
El ciclo biológico natural involucra al transmisor, además de múltiples especies de vertebrados infectados que incluyen al humano. La infección en el humano es adquirida principalmente por la penetración transcutánea del parásito presente en las excretas de insectos hematófagos infectados.
El transmisor, al alimentarse de un mamífero infectado, ingiere junto a la sangre el parásito circulante, en la luz del intestino se multiplican y se desarrollan hacia tripomastigotes metacíclicos que son las formas infectantes y que, junto a los epimastigotes, salen con las deyecciones y penetran piel o mucosas para infectar al mamífero donde circulan como tripomastigotes sanguíneos y posteriormente invaden las células del sistema fagocítico mononuclear, tejido linfoide, muscular o nervioso; donde intracelularmente, los parásitos escapan de la acción lisosomal de la vacuola parasitófora para replicarse por fisión binaria en el citoplasma como amastigotes.
Al finalizar el ciclo de replicación, los amastigotes se diferencian de nuevo en tripomastigotes, que son liberados en el torrente sanguíneo, infectan nuevas células o son ingeridos por el transmisor. (Figura 1)
Este mecanismo, también es conocido como Chagas urbano, es el segundo mecanismo de transmisión debido a que involucra todos los componentes sanguíneos. A la fecha, sólo existe el reporte de un caso en el país.10 En México, 100 % de la sangre y sus componentes empleados para transfusión se tamizan conforme a lo establecido en 2012 en la Norma Oficial Mexicana NOM-253-SSA-1-2012 Para la disposición de sangre humana y sus componentes con fines terapéuticos.
Dentro de las estrategias recomendadas para incrementar la seguridad sanguínea se contempla en todas las unidades de sangre captadas, el tamizaje de las infecciones transmitidas por transfusión de cada región como paludismo, brucelosis y Chagas; esta última con una incidencia de 0.32 % que ha disminuido a nivel nacional en los últimos 5 años. A partir de 2012, con la obligatoriedad del tamizaje en bancos de sangre, se incrementó esta cobertura de 36.5 % en 2005 a 100 % en 2016.11,12
Otros mecanismos menos frecuentes son por trasplantes de órganos y tejidos no sanguíneos, la transmisión materno-fetal o connatal, la ingestión de artrópodos infectados, de carne cruda o insuficientemente cocida y de alimentos o bebidas contaminadas; además de los accidentes en laboratorio descritos a partir de 1939, el primer caso que ocurrió en Francia con una cepa de origen mexicano.1,13,14,15
Patogénesis de la cardiopatía chagásica crónica
Incluso cuando en la enfermedad de Chagas se ha realizado investigación durante más de 100 años, su patogénesis es muy controvertida y no del todo comprendida, debido a la compleja interacción parásito-huésped.
En 1922 se reportan por primera vez trastornos autonómicos en pacientes chagásicos, y en 1929 Magarinos Torres describe la encefalitis y la endocarditis fibrosa por T. cruzi con formación de trombos;16-17 y es hasta 1949 en que Oria y Ramos describen el daño neuronal parasimpático en corazón de casos afectados por megaesófago.
En la década de los cincuenta, Köberle sistematiza el estudio histopatológico en sistema nervioso autónomo para conteo neuronal y describe no sólo la disminución importante del número de neuronas, sino también el parasitismo neuronal cardiaco asociado a intensa periganglionitis y anormalidades degenerativas en la células de Schwann y las fibras nerviosas.18 Posteriormente en 1979, Santos describe reacciones de auto inmunidad en contra de neuronas.
La patogénesis de las lesiones en la cardiopatía chagásica crónica depende de la persistencia parasitaria con una respuesta inmune exacerbada, indiscutiblemente relacionada con la agresión del miocardio y del sistema nervioso autónomo.
Este proceso se presenta después de la infección y la lisis de las células miocárdicas con la consecuente respuesta inmune específica contra T. cruzi con activación de células fagocíticas y citotóxicas, producción de citocinas tipo Th1 (IL-1, IFN-Ɣ y TNF-α), activación y reclutamiento de monocitos in situ para el control de la replicación parasitaria; durante esta fase, la respuesta es protectora para el huésped y en la cronicidad se torna dañina para el miocardio por un proceso inflamatorio exacerbado a expensas principalmente de linfocitos T.
En la fase aguda, el daño a los tejidos del corazón y del tracto digestivo se relaciona directamente con la parasitemia y el parasitismo en tejidos, y durante la cardiopatía crónica, el proceso inflamatorio crónico se debe principalmente a la presencia de TGF-β. La lesión característica es de miocarditis difusa con linfocíticos infiltrados de escasos elementos parasitarios y pequeños focos inflamatorios que generan hipertrofia con miocitolisis e intensa fibrosis reparativa que conducen a remodelación ventricular y deterioro de la función cardíaca.
La inflamación periganglionar en parasimpático con adhesión de las células mononucleares inflamatorias a las neuronas conduce a la lisis y, aunado a la reacción autoinmune neuronal, condiciona la disfunción autonómica característica de todas las fases de la enfermedad, incluso en las formas asintomáticas reversibles parcialmente cuando es tratada de manera oportuna; estas alteraciones en la cronicidad pueden condicionar muerte súbita, arritmias malignas áreas disinérgicas en ambos ventrículos que deterioran la función ventricular global con cardiomegalia.19-23
Las anomalías microvasculares conducen a isquemia miocárdica por incremento en la adhesión plaquetaria del endotelio microvascular debido al proceso inflamatorio; la presencia de trombos es frecuente en el ventrículo izquierdo y en la aurícula derecha, además se asocia principalmente con trombosis pulmonares o cerebrales y son causa de muerte en cardiópatas crónicos.19,21,22 Respecto a la autoinmunidad, Torres señala desde 1941 que la infección repetida por T. cruzi genera un estado caracterizado por infiltrados difusos con macrófagos, células plasmáticas y linfocitos con proliferación de tejido conectivo, que corresponde a una respuesta de hipersensibilidad tardía (Tipo IV)17.
Se ha comprobado que más de 80 % de casos en esta miocardiopatía presenta anticuerpos autorreactivos en contra de diversos tejidos, estructuras tisulares, células e incluso contra receptores β adrenérgicos y muscarínicos.23-24
Manifestaciones clínicas
La enfermedad presenta las fases aguda y crónica, ésta última puede ser asintomática (anteriormente conocida como indeterminada), es decir, sin patología demostrada; la sintomática, donde sí existe patología demostrada. La fase aguda se presenta entre 5 y 10 % de los infectados, con duración desde dos semanas hasta cuatro meses; la sintomatología inicia en 7 o 10 días después de la infección y en los casos de transfusionales entre 20 y 40 días.13,14
Los niños menores son los más afectados y aproximadamente 75 % presenta sintomatología relacionada con la vía de entrada del parásito. Las manifestaciones sistémicas son inespecíficas y la fiebre es lo más frecuente, sin características especiales; en aproximadamente la mitad de estos casos, cuando la vía de entrada es cerca de la mucosa ocular, se presenta el signo de Romaña-Mazza, que consiste en un edema bipalpebral unilateral de color violáceo con adenopatías regionales.
Cuando la vía de entrada es en otra región, se denomina chagoma de inoculación (25 %) que es una lesión nodular subcutánea también de color violáceo. Otras manifestaciones sistémicas inespecíficas menos frecuentes son mialgias, artralgias y hepato o esplenomegalia. En menos de 1 % se complica con meningoencefalitis, miocarditis o pericarditis con evolución generalmente fatal, sobre todo en los extremos de la vida o cuando se asocian con otras patologías severas. (Figura 2)
La fase crónica asintomática o indeterminada dura entre 2 y 20 años o más con la parasitemia muy baja, por lo que los métodos serológicos son de elección para el diagnóstico; después de esta, se presenta la fase crónica sintomática en la que 27 % desarrolla lesiones cardíacas, 6 % digestivas, principalmente en esófago y colon; y 3 % en el sistema nervioso periférico.25
En la fase crónica sintomática, el órgano más afectado es corazón, con alteraciones en la contractilidad y conductibilidad, insuficiencia cardiaca progresiva y cardiomegalia; muestra gran variedad de manifestaciones clínicas cuando la extensión del daño es pequeño, las anormalidades son mínimas o ausentes y el trazo electrocardiográfico puede ser normal.
Si antes o durante esta fase se administra el tratamiento antiparasitario, este será eficaz con muy buen pronóstico; cuando el daño cardiaco evoluciona, se presentan áreas de contracción anormal por alteraciones en la conducción por lesión parasimpática y clínicamente pueden iniciar con disnea progresiva; si el daño es severo, se manifiesta como una disfunción segmentaria o global por la fibrosis y dilatación cavitaria con insuficiencia.
La disnea es el síntoma más frecuente, aunque también pueden presentarse taquicardia, palpitaciones y algias.26-28 Es característico en esta cardiopatía la presencia de arritmias, las extrasístoles ventriculares son frecuentes y después los bloqueos de rama incompletos o completos; las taquisistolias y la fibrilación auricular son menos frecuentes, pero de pronóstico grave.
La muerte se presenta súbitamente en estas arritmias o por insuficiencia progresiva del miocardio;29,30 la fisiopatología está condicionada a la presencia de baja fracción de eyección por disminución de la contractilidad del ventrículo izquierdo, las arritmias ventriculares malignas por la fibrosis multifocal, la bradicardia extrema por la disautonomía parasimpática que puede generar síncope o muerte, tromboembolismo o por la ruptura de aneurisma apical.8,31,32 (Figura 3)
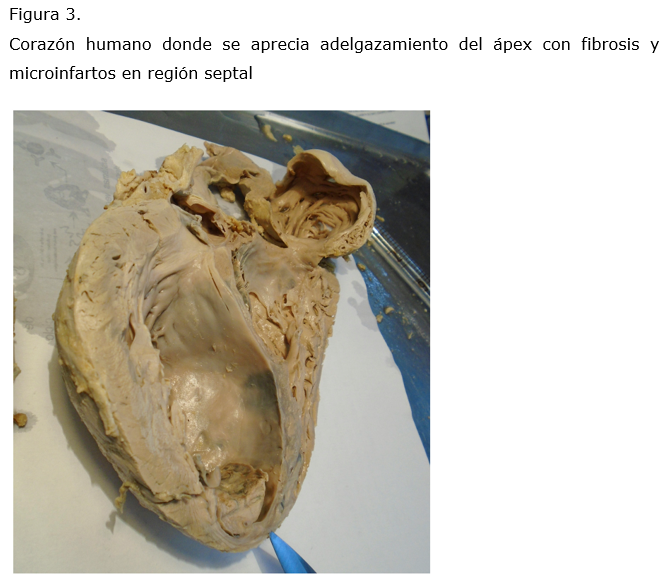
En México, al igual que en otros países endémicos, esta cardiopatía debe considerarse desde la adolescencia como una posibilidad diagnóstica en todo individuo con arritmia, tromboembolismo, insuficiencia cardiaca de predominio derecho, cardiomegalia y trastornos de la conducción, en especial la asociación del bloqueo de la rama derecha con hemibloqueo de fascículo anterior izquierdo, así como el bloqueo auriculo-ventricular.33 El pronóstico de los pacientes que presentan manifestaciones cardiacas severas es malo, habitualmente no sobreviven más de cinco años.
Además del corazón, puede afectar cualquier víscera hueca principalmente del aparato digestivo, donde ocasiona megaesófago y megacolon y en menor frecuencia mega síndromes que afectan estómago, duodeno, vesícula biliar, uréteres, vesícula, útero y bronquios.
Diagnóstico de laboratorio
Existen diversos procedimientos y técnicas para establecer el diagnóstico de la infección y se utilizarán aquellos que estén indicados según la fase clínica que se sospeche y de la infraestructura y personal capacitado disponibles. En términos generales, pueden catalogarse como parasitológicos o serológicos.
Fase aguda
La característica principal de esta fase es la presencia del parásito en sangre, por lo que se recomienda utilizar métodos para comprobar la presencia de los tripomastigotes sanguíneos. Los métodos más utilizados son el examen directo en fresco, frotis, gota gruesa y microhematocrito; si existe la posibilidad, pueden utilizarse medios de cultivo o incluso inoculación de animales de laboratorio. Actualmente, el xenodiagnóstico directo no se emplea debido a las reacciones de hipersensibilidad que pueden presentarse.
Fase crónica asintomática y sintomática
El diagnóstico de infección se confirma al demostrar la respuesta de anticuerpos frente al parásito; las técnicas convencionales recomendadas por la OPS/OMS son ELISA (enzyme linked immuno sorbent asssay), IFI (inmunofluorescencia indirecta) y HAI (hemaglutinación indirecta).
El criterio de seropositividad se confirma al demostrar reactividad en dos pruebas o más de diferente principio. El resultado serológico es indicativo de infección y no del estado clínico del paciente; también, puede ser útil el empleo de tiras de diagnóstico rápido; respecto a la reacción en cadena de la polimerasa (PCR), actualmente, se utilizan con fines de investigación, aun no son recomendadas como métodos para el diagnóstico, debido a que se ha visto que presentan menor sensibilidad por las fluctuaciones en la carga parasitaria.9,14
Estudios de gabinete
Para determinar la fase clínica del paciente, a todo seropositivo, en caso de ser factible y existir la infraestructura, se le deben realizar los siguientes estudios de gabinete.
Electrocardiograma (ECG) convencional de doce derivaciones, si es posible con DII largo, Telerradiografía de Tórax en proyección posteroanterior (PA) y ecocardiograma transtorácico (ECO).14,34,35
Tratamiento
Con el objeto de eliminar la infección y prevenir lesiones viscerales, el tratamiento etiológico está especialmente indicado durante la fase aguda y debe administrase a todos los casos de infección y a todo individuo con serología positiva hasta la edad de 70 años, sin contraindicaciones.
Actualmente, solo existen dos medicamentos aprobados, el benznidazol y el Nifurtimox; ambos controlados por la Secretaría de Salud y no existen comercialmente en ningún país. En niños y adolescentes el tratamiento en general es bien tolerado y ha demostrado una alta tasa de curación de la infección. El nifurtimox se recomienda utilizar en dosis de 8 a 10 mg/kg/día y el benznidazol en dosis de 5 a 7 mg/kg/día; ambos con duración de 30 a 60 días y debe ser rigurosamente supervisado con biometría hemática, química sanguínea, examen general de orina y pruebas de función hepática y renal por sus efectos tóxicos.13,28
El tratamiento de la cardiopatía es para el control de la insuficiencia cardiaca y la prevención de fenómenos tromboembólicos; además, puede estar indicada la implantación de marcapasos, resincronizadores y cardiodesfibriladores.28
Prevención
En varias regiones de Latinoamérica se ha avanzado considerablemente en el control de la transmisión natural; sin embargo, a pesar de estos esfuerzos, la OMS enfatiza dos pilares fundamentales: la atención a los pacientes infectados, enfermos y sus convivientes, debido a que están expuestos al vector, además de la interrupción de la transmisión, en especial la transmisión vectorial intradomiciliaria y la transmisión transfusional y por trasplantes de órganos.
El control vectorial se enfoca principalmente en el uso de insecticidas de acción residual y el mejoramiento de la vivienda, uso de mosquiteros y educación para la salud, sobre todo lo referente a la higiene de las viviendas para evitar la infestación y colonización de triatóminos.
Para lograr efectos permanentes de las intervenciones de control, es importante la educación de la población a través de la participación comunitaria.
En México, únicamente se realizan acciones para la confirmación de casos con patologías severas por lo que es de suma importancia realizar acciones de detección temprana de casos, con énfasis en edades pediátricas con dos finalidades: determinar la transmisión activa de la infección y realizar las intervenciones para interrumpir la transmisión vectorial y además, por otro lado, para otorgar el tratamiento antiparasitario oportuno, antes de que se presenten lesiones irreversibles.
- Chagas C. Nova tripanozomiaze humana. Estudos sobre a morfología e o ciclo evolutivo do Schizotrypanum cruzi n. gen., n. sp., ajente etiologico de nova entidade morbida do homem. Mem Inst Oswaldo Cruz. 1909;1:159-218.
- WHO 2015. Chagas disease in Latin America: an epidemiological update based on 2010 estimates. Weekly Epidemiological Record, 90, 33-44.
- OMS/A62/17/2009. 62ª Asamblea Mundial de la Salud. Enfermedad de Chagas: control y eliminación, 20 de marzo de 2009. Disponible en: http://www.paho.org/hq/index.php?option=com_docman&task=doc_view&gid=15377&Itemid=
- OMS/A63/17/2010. 63ª Asamblea Mundial de la Salud. Enfermedad de Chagas: control y eliminación 22 de abril del 2010. Disponible en: http://apps.who.int/gb/ebwha/pdf_files/WHA63/A63_17-sp.pdf
- Sustaining the drive to overcome the global impact of neglected tropical diseases: second WHO report on neglected tropical diseases, January 2013. Disponible en: http://www.who.int/neglected_diseases/9789241564540/en/
- Tay J, Salazar PM, Bucio MI, et al. Estado actual de nuestros conocimientos sobre la enfermedad de Chagas en la República Mexicana. Rev Soc Bras Med Trop. 1981;14(1):32-40.
- Salazar-Schettino PM, Rojas-Wastavino GE, Cabrera-Bravo M, et al. A revision of thirteen species of Triatominae (Hemiptera: Reduviidae) vectors of Chagas disease in México. J Selva Andina Res Soc. 2010;1:57-80.
- OMS/OPS: Reporte sobre la enfermedad de Chagas. Grupo de trabajo científico. 17 a 20 de abril de 2005. Actualizado en julio de 2007. Buenos Aires, Argentina. www.who.int/tdr. Disponible en: http://whqlibdoc.who.int/hq/2007/TDR_SWG_09_spa.pdf
- Hashimoto K, Schofield CJ. Elimination of Rhodnius prolixus in Central America. Parasites & Vectors. 2012;5:45.
- Salazar PM, Barrera M, Bucio MI. Transmisión de Trypanosoma cruzi por transfusión sanguínea, primer caso humano en México. Mex Patol Clin. 1989;36:57-9.
- NORMA Oficial Mexicana (NOM-253-SSA1-2012). Para la disposición de sangre humana y sus componentes con fines terapéuticos. 2012. Disponible en: http://www.dof.gob.mx/normasOficiales/4917/salud3a/salud3a.html.
- Rojo Medina J. Enfermedades infecciosas transmitidas por transfusión. Panorama internacional y en México. Gac Med Mex. 2014;150:78-83.
- Guías para la atención al paciente infectado con Trypanosoma cruzi (Enfermedad de Chagas) [Internet]. Buenos Aires: Ministerio de Salud de la Nación, 2012. Disponible en:http://www.msal.gov.ar/chagas/images/stories/Equipos/Guia_Nacional_Chagas_version_27092012.pdf
- Wendel S, Brener ME, Carmargo A, Rassi A. Chagas Disease (American Trypanosomiasis): its impact on transfusion and clinical medicine. ISBT Brazil 92. 1992.
- Brumpt E, Mazzotti L, Brumpt LC. Enquetes épidémiologiques sur la maladie de C. Cbagas au Mexique (1). Réduvidés vecteurs. Animaux réservoirs de virus. Cas Humains. Ann Parasitol. 1939;17(4):299-312,1939.
- Torres CM. Sobre a anatomia patológica da doença de Chagas. Mem Inst Oswaldo Cruz. 1941;36(3):391-404.
- Torres M, Villaca JR. Encefalite e mielite cauzadas por um Tripanozomo (T. cruzi). Mem Inst Oswaldo Cruz. 1919;11(1):80-9.
- Köberle F. Chagas’ heart disease and Chagas’ syndromes: the pathology of American trypanosomiasis. Adv Parasitol. 1968;6:63‑116.
- Marín-Neto JA, Cunha-Neto E, Maciel BC, Simões MV. Pathogenesis of Chronic Chagas Heart Disease. Circulation. 2007;115:1109-23.
- Marin-Neto JA, Rassi Jr. A. Actualización sobre la cardiopatía de la enfermedad de Chagas en el primer centenario de su descubrimiento. Rev Esp Cardiol. 2009;62(11):1211-6.
- Herrera RN, Díaz E, Pérez R, et al. Estado protrombótico en estadios tempranos de la enfermedad de Chagas crónica. Rev Esp Cardiol. 2003;56(4):377-82.
- Teixeira ARL, Nascimento RJ, Sturm NR. Evolution and pathology in Chagas disease-A Review. Mem Inst Oswaldo Cruz 2006;101(5):463-91.
- Cunha-Neto E, Bilate AM, Hyland KV, et al. Induction of cardiac autoimmunity in Chagas heart disease: a case for molecular mimicry. 2006;39(1):41-54.
- Borda ES, Sterin-Borda L. Antiadrenergic and muscarinic receptor antibodies in Chagas’ cardiomyopathy. Int J Cardiol. 1996;54(2):149‑56.
- Moncayo A. Progress Towards Interruption of Transmission of Chagas Disease. Mem Inst Oswaldo Cruz. 1999;94(1):401-4.
- Rossi MA, Ramos SG. Coronary microvascular abnormalities in Chagas’ disease. Am Heart J 1996;132(1):207-10.
- Acquatella H. Patología del corazón de origen extracardíaco (V). Avances recientes en miocardiopatía chagásica. Rev Esp Cardiol. 1998;51(2):152-7.
- Consenso de Enfermedad de Chagas-Mazza. Sociedad Argentina de Cardiología. Rev Argent Cardiol. 2011;79(6):544-564.
- Chagas C. Nova entidade morbida do homem: rezumo geral de estudos etiolojicos e clinicos. Mem Inst Oswaldo Cruz. 1911;3(2):219-75.
- Chagas C, Villela E. Forma cardíaca da Trypanosomiase Americana. Mem Inst Oswaldo Cruz. 1922;14:5-61.
- Consenso de Prevención Primaria y Secundaria de Muerte Súbita. Sociedad Argentina de Cardiología. Rev Argent Cardiol. 2012;80(2):165-84.
- Rassi Jr, Rassi SG, Rassi A. Sudden Death in Chagas’ Disease. Arq Bras Cardiol. 2001;76(1):86-96.
- Salazar-Schettino PM, Perera R, Ruiz-Hernández et al. Chagas Disease as a Cause of Symptomatic Chronic Myocardopathy in Mexican Children. Pediatr Infect Dis J. 2009;28(11):1011-3.
- Viotti RJ, Vigliano C, Laucella S, et al. Value of echocardiography for diagnosis and prognosis of chronic Chagas disease cardiomyopathy without heart failure. 2004;90:655-60.
- Acquatella H. Echocardiography in Chagas Heart Disease. Circulation. 2007;115(9):1124-31.
