Heriberto Medina Franco
Secretaría de Salud, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán. Ciudad de México, México.
Correspondencia: [email protected]
Teléfono: 5665 5806 / 5606 622
Lorelí Mejía Fernández
Secretaría de Salud, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán. Ciudad de México, México.
Correspondencia: [email protected]
El manejo adecuado del nódulo solitario de cuello requiere de la realización de una adecuada evaluación clínica y de un amplio diagnóstico diferencial, lo cual implica aspectos variados debido a las diferentes etiologías: benignas, malignas, congénitas e inflamatorias. Las neoplasias malignas de glándulas salivales representan aproximadamente 3% de todos los cánceres de cabeza y cuello1,2,3. Su abordaje diagnóstico inicia generalmente con el hallazgo de un nódulo en cuello. Por esta razón, el abordaje sistemático se debe realizar siempre que un paciente acuda presentando dicho motivo de consulta.
El diagnóstico y manejo de estos nódulos y, en especial, de las neoplasias malignas en cuello necesita de la combinación de un amplio examen clínico y el uso de diversas técnicas diagnósticas. La epidemiología sobre esta patología ha cambiado en los últimos años; el aumento significativo de los cánceres orofaríngeos se atribuye a la mayor cantidad de pacientes jóvenes infectados con el virus del papiloma humano, que causa hasta 80% de dichos cánceres. Las neoplasias de glándulas salivales mayores y menores, las cuales tienen un pico de incidencia entre las edades de 65 y 74 años, se generan principalmente en la glándula parótida y, en menor proporción, en las glándulas sublinguales. Solo un pequeño número (aproximadamente 15%) de los tumores en la parótida posee características malignas1,2,3.
En la actualidad, la tomografía computarizada (TC), junto con otras herramientas diagnósticas como la resonancia magnética (RM) y la biopsia por aspiración con aguja delgada (BAAD), es el estudio de elección para el diagnóstico de las tumoraciones de glándulas salivales. Por su parte, las biopsias excisionales pueden ser la mejor opción diagnóstica y terapéutica para los nódulos solitarios.
Historia clínica y exploración física
La masa persistente en cuello de un adulto siempre genera preocupación, ya que generalmente es la única manifestación de una patología maligna. Generalmente, el hallazgo de una masa en cuello se da de dos formas: el paciente acude a consulta porque notó la masa por sí mismo, o mediante una exploración física realizada por el médico. La sintomatología puede variar y ser mínima o nula, o dolorosa e incapacitante, incluso complicada con parálisis facial, sin embargo una glándula salival inflamada y dolorosa debe contemplar dentro de sus diagnósticos diferenciales una neoplasia.
Ante una historia clínica, el primer factor que debe tomarse en cuenta —tal vez es el de mayor importancia— es la edad. Basándonos en la edad, una adecuada historia clínica y en exploración física, podemos llegar a un diagnóstico acertado sin la necesidad de realizar otros estudios. En la edad pediátrica 90% de las masas son benignas4,5. Por su lado, las masas malignas en niños son infrecuentes y las más comunes son los linfomas y, en menor medida, los rabdomiosarcomas y neuroblastomas.
La etiología más común suele ser inflamatoria y, después, las causas congénitas. La linfadenitis cervical es el origen más frecuente, y esta a su vez es causada por agentes infecciosos como citomegalovirus, virus del Epstein-Barr, parotiditis viral, adenovirus, ecovirus, rinovirus y virus sincicial respiratorio. Dentro de las masas congénitas se incluyen los quistes del conducto tirogloso y de la hendidura braquial. En adultos jóvenes la distribución es semejante a la mencionada en niños, sin embargo a las etiologías infecciosas se unen aquellas relacionadas con enfermedades de transmisión sexual. En adultos mayores de 40 años, las etiologías se invierten: las malignas son las más comunes, en especial en la población de los adultos mayores. El riesgo aumenta considerablemente cuando el paciente presenta antecedentes del uso del tabaco y/o alcohol. Se ha visto una fuerte asociación entre el antecedente de tabaquismo y el desarrollo del tumor de Warthin1. Otro factor de riesgo asociado al cáncer de glándulas salivales es la exposición al polvo de sílica y nitrosamina. También se ha encontrado relación de la nuliparidad y la menarca temprana con un mayor riesgo para el desarrollo de esta patología. La mayor parte de estas masas en adultos se debe a carcinoma metastásico con el primario en cabeza o cuello, así como a aquellos provenientes del tracto digestivo y respiratorio.
Durante el interrogatorio se debe investigar sobre antecedentes de exposición a radiación, que incrementan significativamente la incidencia de cáncer de tiroides y tumores neurales. Como se mencionó previamente, el uso de alcohol y tabaco aumentan exponencialmente el riesgo de una neoplasia maligna. El estatus de la infección por virus de inmunodeficiencia adquirida (VIH) también debe explorarse. Hay una asociación entre la infección por virus del Ebstein-Barr y un carcinoma linfoepitelial de las glándulas salivales, que ocurre en menos de 1% de estas neoplasias1. Si la sintomatología incluye fiebre, sudoraciones nocturnas o la pérdida de peso (síntomas B), puede hacer sospechar de linfoma, mientras que la fiebre de alto grado nos orienta más a una etiología infecciosa (Figura 1).
El antecedente de linfoma de Hodgkin aumenta el riesgo de presentar cáncer salival a edades más tempranas que las que supone la tendencia epidemiológica.
El tiempo de evolución y la tasa de crecimiento de la masa nos señalan el origen de esta. Una masa de expansión rápida en una mayor proporción es de etiología inflamatoria. El dolor asociado al crecimiento de una masa generalmente es de naturaleza inflamatoria, sin embargo se debe pensar que una infiltración en el trayecto de un nervio también puede generar dolor. En pacientes mayores de edad, deshidratados, malnutridos o inmunocomprometidos es común diagnosticar una parotiditis aguda bacteriana asociada a sialolitiasis. Aquellas masas secundarias a procesos infecciosos, como en el caso de la linfadenitis cervical, pueden desarrollar hiperplasia reactiva y tardar algunas semanas en involucionar. Por otro lado, las linfadenopatías cervicales de más de tres meses de evolución se suelen encontrar en pacientes con VIH. Los pacientes con síndrome de Sjögren u otro trastorno autoinmune presentan un edema bilateral de la glándula en la mayoría de los casos. La obstrucción del conducto de Stenon suele ocasionar un edema doloroso agudo5.
Durante la exploración física deben documentarse el tamaño de la masa, su movilidad, su fijación a la piel o a estructuras profundas, limitación de la apertura mandibular, asimetría faríngea, dolor a la palpación, lesiones en piel cabelluda que sugieran neoplasia primaria, examinación detallada del nervio facial y la exploración de las cadenas ganglionares cervicales. El factor que debe tomarse en cuenta de manera imprescindible es la localización de la masa1,2,4,5,6.
Para dicha exploración debe reconocerse adecuadamente la anatomía de cabeza y cuello. El cuello y su drenaje linfático se dividen, para su estudio y exploración, en central y lateral. La mayoría de los ganglios linfáticos se exploran debajo de los planos musculares del esternocleidomastoideo lateral, y los músculos pretiroideos en la línea media. El cuello central incluye el hueso hioides, tiroides, cartílagos cricoides, istmo tiroideo y tráquea. El cuello lateral está dividido por el músculo esternocleidomastoideo en triángulo anterior y triángulo posterior. El triángulo anterior tiene su límite inferior en la mandíbula y abarca en su parte superior hasta la unión del esternocleidomastoideo y el esternoclavicular. Este triángulo a su vez se puede subdividir por el músculo digástrico en submentoniano y submandibular. El triángulo posterior inicia en la clavícula y limita en su parte superior con la apófisis mastoides, su límite posterior es el músculo trapecio.
Las masas superficiales sugieren la posibilidad diagnóstica de un lipoma o quiste sebáceo, diferenciándose el primero por su falta de adherencia a la piel suprayacente. Las masas en planos profundos sugieren tumoración en cuello. Aquellas masas en la línea media generalmente son quistes en desarrollo y se presentan desde las primeras décadas de vida; puede tratarse de teratomas, quistes dermoides y lesiones derivadas del conducto tirogloso, además de masas malignas. Los quistes tiroglosos se encuentran en la línea media y presentan un movimiento hacia arriba cuando el paciente deglute. Los quistes dermoides, por su lado, se presentan en la piel con un pequeño hoyuelo con un pelo central. En la región preauricular y el ángulo de la mandíbula se presentan masas parotídeas y del tejido linfático; en esta región siempre debe evaluarse la función del nervio facial. En la región anterior al músculo esternocleidomastoideo, especialmente en la unión yúgulo-digástrica, los ganglios aumentados de tamaño sugieren una alta probabilidad de malignidad; sin embargo, en edad pediátrica esta región puede presentar quistes de la segunda hendidura braquial. Masas en el triángulo posterior se asocian igualmente con mayor malignidad. Las masas supraclaviculares sugieren metástasis mamarias y pulmonares como primera causa, siguiéndoles las gastrointestinales y ginecológicas; estas dos últimas suelen metastatizar a los nódulos supraclaviculares del lado izquierdo, al nódulo de Virchow, debido al drenaje del conducto torácico en las venas subclavias y las yugulares internas del lado izquierdo. El cuadro 1 resume la asociación de las características de la masa con la etiología.
Cuadro 1. Características de los nódulos solitarios en cuello1 | |
| Etiología asociada | Características de la masa |
| Ganglio linfático reactivo | Discreta, móvil, firme y con dolor mínimo. |
| Malignidad | Textura rocosa, fija. En linfomas se asocia a rápido crecimiento. |
| Infección | Asimétricas, aisladas, dolorosas a la palpación, calientes, eritematosas y de rápido crecimiento. |
| Congénitas | Suaves, consistencia globosa y móviles. |
| Vascular | Firme, de localización lateral con movimientos laterales, pero no en sentido vertical; sugiere tumor de cuerpo carotídeo. Un schwannoma del vago puede presentar las mismas características. |
| Tiroideo | Inmóvil con elevación de la masa al deglutir. |
Otra manera esencial de localizar las masas es utilizando el esquema del Memorial Sloan-Kattering4,7, que organiza los ganglios linfáticos cervicales en niveles. (Figura 2)
Esta clasificación también puede conducir al origen de una tumoración primaria con metástasis a las cadenas ganglionares. (Cuadro 2)
Cuadro 2. Sitios primarios de metástasis a ganglios linfáticos cervicales solitarios1 | |
| Nivel cervical | Sitios primarios de metástasis |
| I | Piel, labio, cavidad oral, glándula submandibular, glándula parótida, senos paranasales. |
| II | Parótidas, cavidad oral, orofaringe, laringe, hipofaringe, nasofaringe, tiroides. |
| III | Cavidad oral, orofaringe, hipofaringe, laringe, tiroides, esófago cervical. |
| IV | Orofaringe, hipofaringe, laringe, tiroides, primario inflaclavicular, esófago cervical. |
| V | Nasofaringe, piel, tiroides, primario inflaclavicular. |
| VI | Tiroides, laringe, hipofaringe, esófago cervical. |
Una manera adecuada de realizar la exploración física al paciente es controlando con una mano la cabeza del paciente y realizando una flexión leve del cuello hacia el lado a examinar para relajar los músculos y facilitar la exploración de estructuras profundas. La observación y la palpación son los momentos más importantes de la exploración: se debe observar si hay algún cambio de la masa durante la maniobra de Valsalva, el cual indicaría la relación de la masa con el tracto respiratorio-digestivo superior y un posible laringocele. Los hallazgos de la historia clínica y la exploración física serán la guía para proseguir y seleccionar los estudios de gabinete necesarios para completar el diagnóstico.
Exploración y características de las tumoraciones en glándulas salivales
Los tumores de glándulas salivales son raros: llegan a alcanzar entre 6 y 8% de todas las tumoraciones en cabeza y cuello1,2; tienen un ligero predominio en el sexo femenino. Las tumoraciones benignas suelen presentarse entre la quinta y la séptima década de vida, mientras que las malignas un poco más tarde. El 54% de estas tumoraciones son benignas; el adenoma plemórfico es el más frecuente (alcanza 84%), y es seguido por el tumor de Warthin (con una frecuencia de 12%). Este tipo de neoplasias suelen tener larga evolución y un baja tasa de crecimiento. Hasta 46% son neoplasias malignas8. El 34% es abarcado por el carcinoma mucoepidermoide, seguido por el carcinoma adenoideo quístico con 22%, el adenocarcinoma con 13%, carcinoma de células acinares con 7% y el carcinoma de células escamosas con 4%.
Como se mencionó previamente, el paciente suele acudir a consulta por una masa indolora o por inflamación de la glándula parótida, submandibular y sublingual. En el caso de las glándulas salivares menores, se puede presentar una masa submucosa indolora o ulceración de la mucosa del paladar, labios o carrillos; estas úlceras tienen apariencia de un carcinoma escamocelular o sialometaplasia. Aquellas glándulas menores que se encuentran en la cavidad nasal o maxilar se pueden presentar con los síntomas de obstrucción nasal, congestión, cambios en la visión o trismus, mientras que aquellas que se encuentran en la nasofaringe se presentan en etapas avanzadas con invasión de la base de cráneo e inclusive de los nervios craneales.
Glándula parótida
La glándula parótida es la glándula salival de mayor tamaño y la únicas que contiene ganglios linfáticos intraglandulares1,2,12; constituye el primer lugar de drenaje de las neoplasias malignas ubicadas en el nivel I y II del cuello. Anatómicamente se divide en lóbulos superiores y profundos, de acuerdo con el trayecto del nervio facial; en el superficial se encuentra la mayor parte del tejido linfático. Por otro lado, es la glándula salival donde se presentan de forma más frecuente tumoraciones, que abarcan entre 70 y 85%, de las cuales solo 25% son tumoraciones malignas1,8. En contraste con las otras glándulas, 40 a 45% de los tumores en la submandibular, 70 a 90% en la sublingual y entre 50 y 75% en las salivares menores son de etiología maligna.
Al igual que en cualquier otra, se debe palpar la glándula y evaluar al mismo tiempo la piel. Es necesario realizar una exploración bimanual que se enfoque en la evaluación del conducto de Stenon. Los tumores en esta glándula tienden a encontrarse delante y debajo de la oreja; los tumores benignos tienden a ser bien definidos, indoloros y móviles, y se localizan usualmente en la cola de la misma. Es de vital importancia la exploración del nervio facial, ya que, de acuerdo con la función afectada, se puede obtener información de la localización tumoral; además, la presencia de paresia o parálisis del nervio facial, de fijación de la masa a la piel o de estructuras adyacentes y adenopatía cervical se correlacionan con alta probabilidad de malignidad.
El espacio parafaríngeo en el compartimiento anterolateral o preestiloideo se afecta por tumores en el lóbulo profundo de la glándula parótida, los cuales se presentan como una masa submucosa que protruye en la orofaringe o nasofaringe, distorsiona la anatomía del paladar blando u obstruye la trompa de Eustaquio. Cuando el tumor afecta el compartimento posterolateral del espacio parafaríngeo, se presentan alteraciones de los nervios craneales. (Cuadro 3) (Figura 3)
Cuadro 3. Pares craneales afectados por tumoraciones de la glándula parótida | |
| Función alterada | Par craneal afectado |
| Reflejo nauseoso | IX y X |
| Aspiración | IX y X |
| Elevación asimétrica del paladar | X |
| Ronquera | X |
| Disfagia | X |
| Debilidad del trapecio | XI |
| Atrofia o paresis de la lengua | XII |
Glándula submandibular
Es la segunda glándula salival más grande. Se localiza anatómicamente en el nivel Ib del cuello. Tiene una relación estrecha con los nervios lingual e hipogloso, la arteria y vena facial, junto a su respectiva rama del nervio facial. Drena a la cavidad oral mediante el conducto de Wharton; hace el drenaje linfático hacia los ganglios perivasculares y continúa hasta la región cervical. Hasta 28% de las neoplasias malignas de esta glándula se presentan con metástasis a los ganglios regionales1,2,4,5.
Su exploración física debe realizarse de igual forma, bimanual. Las masas benignas generalmente son indoloras y móviles, y se encuentran en el triángulo submandibular. Se debe explorar la sensibilidad de la lengua, pues las parestesias pueden sugerir involucramiento del nervio lingual, debilidad que a su vez sugiere toma del hipogloso o debilidad del labio inferior, donde se involucra el nervio facial. Estas masas malignas suelen estar fijas y presentar metástasis a ganglios cervicales, que se palpan aumentados de tamaño. Al contrario, las tumoraciones benignas son poco frecuentes y se presentan como masas móviles e indoloras en el triángulo submandibular.
Glándula sublingual
Las glándulas sublinguales se localizan anatómicamente en el piso de la boca, en los laterales del frenillo. Mediante los conductos de Bartholini se drena su contenido a los conductos de Warthon. Su drenaje linfático es hacia los ganglios submentonianos y submandibulares. El 86% de las tumoraciones en estas glándulas suele ser maligno8.
Clínicamente, las tumoraciones se manifiestan como masas indoloras. Al realizar la exploración física de forma bimanual se debe evaluar la fijación de los tumores de dichas glándulas a la mandíbula. A su vez, la estrecha correlación anatómica de estas glándulas con los nervios hipogloso y lingual puede causar alteraciones neurológicas.
Glándulas salivales menores
Son un total de entre 500 y 1000 glándulas distribuidas en todo el tracto aerodigestivo. Histológicamente, se pueden encontrar en la capa submucosa y suelen caracterizarse por no tener un tejido capsular, razón por la cual tienden a invadir fácilmente el tejido circulante. La mayor parte se encuentra en la cavidad oral, específicamente en el paladar duro. Drenan hacia los ganglios retrofaríngeos.
Los tumores benignos son raros y el más común es el adenoma plemórfico; suelen encontrarse con mayor frecuencia en paladar, espacio parafaríngeo y la glándula lacrimal. La mayoría de las tumoraciones son malignas y suelen manifestarse como una tumefacción indolora, fija a la mucosa y con una ulceración. Cuando la invasión llega a los nervios, el paciente se queja de dolor y parestesias, sin embargo los síntomas son diversos debido a la amplia distribución de este tipo de glándulas.
Diagnóstico
Los hallazgos en el interrogatorio y en la exploración física determinarán los estudios de gabinete y laboratorio que se indicarán. Los estudios de imagen brindan información y detalles más específicos sobre la posición anatómica, la consistencia, la invasión circulante, la vascularidad y la fuente de una tumoración maligna. La TC debe ser el estudio inicial de elección para la mayoría de los pacientes con un nódulo solitario en cuello, aunque pueden usarse otras opciones, como el ultrasonido (US), la resonancia magnética nuclear (RMN) y la tomografía de emisión de positrones (PET/CT)10,11. Aquellos tumores que se originan del lóbulo profundo de la glándula parótida o del espacio parafaríngeo, los tumores de la submandibular y las glándulas menores deben evaluarse con técnicas de imagen de alta resolución.
La RMN es la mejor opción para evaluar las neoplasias de glándulas salivales, ya que delimita bien la arquitectura interna entre los tumores y la glándula sana. Además, tiene una mejor evaluación de la médula ósea y del espacio parafaríngeo. Tanto las neoplasias benignas como las malignas se observan bien en secuencia T14,11. El uso de contraste con gadolinio y saturación de la grasa puede ayudar a definir la invasión de hueso y tejido perineural. La secuencia T2 ayuda a diferenciar las neoplasias benignas de las malignas; las primeras suelen presentar baja señal en T1, y alta en T2 con márgenes bien definidos; las segundas tienen baja señal en T1 y T2 con márgenes mal definidos. En otras palabras, los carcinomas de alto grado suelen caracterizarse por tener intensidades bajas e intermedias en secuencias T1 y T2. Algunos tumores tienen características especiales; por ejemplo, las masas unilaterales que no realzan con una alta señal de T2 o un tumor bilateral en la parótida se asocian a un tumor de Warthin. En el espacio parafaríngeo se pueden encontrar tumores del lóbulo profundo de la glándula parótida y tumores de las glándulas salivales menores que crecen en el compartimiento preestiloideo y desplazan la grasa medialmente. Los tumores de los lóbulos profundos de la parótida están conectados siempre a ella, por lo que en algún corte debe encontrase dicha conexión.
Los tumores de las glándulas menores están rodeados de grasa completamente. Los tumores glómicos y neurogénicos también presentan características especiales por encontrarse generalmente en el compartimiento postestiloideo posterior a la carótida, pero los neurogénicos se distinguen por realzar intensamente el gadolinio, y los glómicos por tener trazos serpiginosos conocidos en “sal y pimienta”. Aún con la información brindada por este tipo de estudio, es necesario realizar la evaluación histopatológica para determinar a ciencia cierta las características específicas y el tipo de neoplasia que presentan los pacientes.
La TC contrastada es un estudio muy utilizado para evaluar las glándulas salivales, y es el de elección para las tumoraciones o nódulos solitarios en cuello. Entre sus ventajas se encuentran la rapidez con la que permite obtener imágenes y su utilidad para evaluar invasión ósea. Es un estudio no invasivo, disponible en la mayoría de los centros oncológicos y de costo accesibles para la mayoría de los pacientes. Es especialmente útil en la evaluación de ganglios retrofaríngeos. Los ganglios linfáticos sospechosos que suelen presentar alguna tumoración maligna o metástasis se caracterizan por tener necrosis central, un tamaño mayor a 1.5 cm, bordes irregulares y confluencia o presencia de múltiples ganglios (Figura 4).
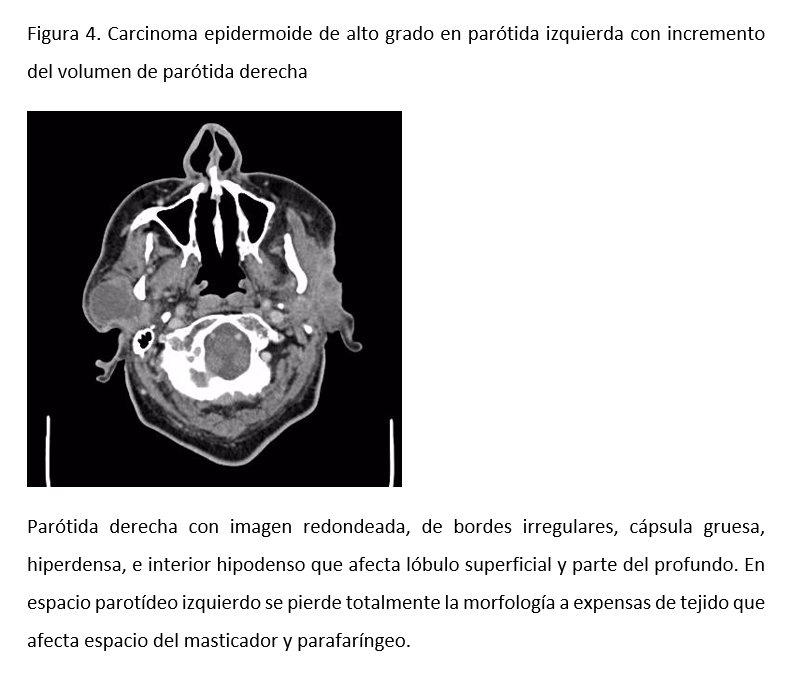
Con estos criterios diagnósticos, la TC alcanza una exactitud diagnóstica de más de 90%. Para la evaluación de un linfoma, la TC de tórax y abdomen ayuda a establecer un estadiaje del curso de la enfermedad.
El ultrasonido tiene la gran ventaja de ser un estudio no invasivo, en tiempo real, barato y de analizar la relación de la masa con las estructuras circundantes. Sin embargo, al ser una herramienta que depende de un operador, las imágenes obtenidas pueden ser limitadas para realizar un diagnóstico adecuado.
La BAAD es una técnica simple y, en muchas ocasiones, la primera herramienta diagnóstica indicada para el estudio de los nódulos solitarios en cuello. Tiene una sensibilidad de 85% y una especificidad de 99%1,6,12,13,14. Esta técnica brinda mayor precisión diagnóstica de las tumoraciones benignas en neoplasias de glándulas salivales. Tiene como ventaja que su realización no expande el tumor a tejidos circundantes, como puede suceder en las biopsias por aguja de corte (Tru-Cut).
Es muy recomendable que durante la realización de este procedimiento un citopatólogo entrenado evalúe si la muestra obtenida es suficiente. Cuando la masa no es palpable, menor a 5 mm o está en una localización de difícil acceso, se puede realizar este procedimiento guiado por ultrasonido14. El tejido aspirado puede ser enviado para su estudio mediante análisis citológico y/o reacción en cadena de la polimerasa para analizar la positividad al virus de Epstein Barr o VPH.
Entre las desventajas del procedimiento, se encuentra el que no es posible enviar el aspirado para su análisis inmunohistoquímico o de la arquitectura del tejido. Las características físicas del tejido aspirado pueden indicar la etiología de la masa; por ejemplo, un fluido café, seroso y oscuro se puede encontrar en el cáncer papilar de tiroides; los líquidos viscosos amarillentos pueden hacer sospechar de un mucocele; aquellos amarillos turbios, de un quiste de hendidura braquial; mientras que aquellos purulentos, de un absceso.
Dentro de sus posibles complicaciones, podemos encontrar la infección y hemorragia. Cuando las muestras de tejido no son diagnósticas, se puede considerar la realización de una biopsia para llegar a un diagnóstico histopatológico correcto. De todos los tumores de cabeza y cuello, las neoplasias de las glándulas salivares mayores son las que suelen tener las tasas más altas de error diagnóstico15. Las tasas de falsos negativos más altas ocurren en los diagnósticos por linfoma, carcinoma de células acinosas, carcinoma mucoepidermoide y carcinoma adenoideo cístico. Finalmente, esta técnica diagnóstica tiene gran impacto en el seguimiento del paciente. Se ha estudiado que hasta en 35% de los diagnósticos realizados por BAAD se cambia el plan de tratamiento con base en los resultados obtenidos15. También ayuda a brindar una mejor recomendación preoperatoria.
Hay otros tipos de biopsias: incisionales, excisionales y centrales. No se recomienda la realización de biopsia incisional excepto en los casos donde la BAAD o la biopsia central son positivas para linfoma y se requiera tejido adicional para la tipificación del mismo. Si la BAAD o la biopsia central son negativas, se puede optar por una biopsia excisional con estudios transoperatorios para decidir el procedimiento a seguir durante la cirugía.
La angiografía puede ser de ayuda en aquellas tumoraciones que presentan invasión de la arteria carotidea o en el diagnóstico diferencial de los tumores del cuerpo carotideo. Sin embargo, nuevos estudios como el ultrasonido dúplex y la angio-tomografía o angio-resonancia magnética han venido a reemplazar este estudio.
Estadiaje
El estadiaje de los tumores malignos de glándulas salivales brindan el pronóstico y, con este, la pauta a seguir en el tratamiento de los pacientes. El sistema tumor-ganglio-metástasis (TNM) para etapificación establecido por el American Joint Committee on Cancer (AJCC)16 y el International Union for Cancer Control (UICC) es la clasificación más utilizada en nuestro medio. Específicamente, en el caso de carcinomas de glándulas salivales menores, se estadifican de acuerdo con el sitio anatómico de origen. (Cuadro 4)
|
Cuadro 4. Sistema TNM para el estadiaje del cáncer de glándulas salivales16 |
|
| Estadiaje para tumores de glándulas salivales (T) | |
| Tx | Tumor primario no se puede evaluar. |
| T0 | Sin evidencia de tumor primario. |
| T1 | Tumor ≤2 cm en su máxima dimensión sin extensión extraparenquimatosa. |
| T2 | Tumor >2 cm pero ≤4 cm en su máxima dimensión sin extensión parenquimatosa. |
| T3 | Tumor >4 cm o tumor con extensión parenquimatosa. |
| T4a | Tumor invade piel, mandíbula, canal auditivo y/o nervio facial. |
| T4b | Tumor invade base del cráneo o apófisis pterigoides. |
| Ganglios linfáticos regionales (N) | |
| Nx | No se pueden evaluar los ganglios linfáticos regionales. |
| N0 | No existe metástasis de ganglios linfáticos regionales. |
| N1 | Metástasis en un solo ganglio linfático ipsilateral, ≤3 cm en su mayor dimensión. |
| N2a | Metástasis de un solo ganglio linfático ipsilateral, >3 cm, pero ≤ 6 cm en su mayor dimensión. |
| N2b | Metástasis en múltiples ganglios linfáticos ipsilaterales, ≤6 cm en su mayor dimensión. |
| N2c | Metástasis en ganglios linfáticos bilaterales o contralaterales, ≤6 cm en su mayor dimensión. |
| N3 | Metástasis en un ganglio linfático, > 6 cm en su mayor dimensión. |
| Metástasis a distancia (M) | |
| Mx | No se pueden evaluar las metástasis a distancia. |
| M0 | No hay metástasis a distancia. |
| M1 | Metástasis a distancia. |
Histopatología
Como se había mencionado previamente, las neoplasias de glándulas salivales son relativamente infrecuentes y representan menos de 2% de todas las neoplasias de dichas glándulas. El 90% de estas tumoraciones son abarcadas por el adenoma pleomorfo, el tumor de Warthin y el carcinoma mucoepidermoide. En el cuadro 5 se muestra una clasificación de las tumoraciones benignas y malignas de acuerdo con su incidencia.
|
Cuadro 5. Tumores de glándula parótida |
|
| Tumoraciones benignas | Tumoraciones malignas |
| Adenoma pleomorfo (tumor mixto)- 50% | Carcinoma mucoepidermoide – 15% |
| Tumor de Warthin (cistoadenoma papilar linfomatoso – 5 al 10% | Adenocarcinoma – 10% |
| Mioepiteliomas – 1% | Adenocarcinoma polimorfo de bajo grado – 5% |
| Adenoma basocelular – 1% | Carcinoma de células acinares – 5% |
| Adenoma canalicular – 1% | Carcinoma adenoideo quístico – 5% |
| Oncocitoma – 1% | Tumor mixto maligno - 3-5% |
| Lipoadenoma – 1% | Carcinoma epidermoide – 1% |
| Adenosis poliquística esclerosante – 1% | |
| Keratocistoma – 1% | |
| Tumor de Kuttner (sialadenitis esclerosante crónica) – 1% | |
| Sialoblastoma – 1% | |
| Hemangiomas – 1% | |
Adenoma pleomorfo
Es una neoplasia benigna con células ductales (epiteliales y mioepiteliales, con diferenciación epitelial y mesenquimatosa). Algunos autores lo llaman tumor mixto. Se presenta en 60% de los tumores de la parótida. El aumento de la exposición a radiaciones es un factor de riesgo para desarrollarlo. Asimismo, reordenamientos cromosómicos que afectan al PLAG1, un gen que codifica un factor de transcripción9, se han asociado a su desarrollo .
Su morfología suele ser la característica de tumoraciones benignas que nunca superan los 6 cm. Suele estar encapsulado, pero en algunas tumoraciones la cápsula no se forma completamente, lo que provoca un crecimiento expansivo y recidivas de estas. Su aspecto macroscópico es blanco grisáceo con zonas mixoides y azuladas translúcidas de tejido condroide. Microscópicamente, el tejido es muy heterogéneo: tiene zonas de células ductales y mioepiteliales rodeadas de tejido mesenquimatoso mixoide laxo con islotes de cartílago.
Tumor de Warthin
Las personas con antecedente de tabaquismo tienen ocho veces más riesgo de desarrollarlo. Es un tumor benigno que surge casi exclusivamente en la parótida y con mayor frecuencia en hombres entre la quinta y la séptima década de vida. Se trata de masas encapsuladas de 2 a 5 cm que generalmente surgen en la zona superficial de la parótida. Macroscópicamente, es un tumor de coloración grisácea y pálida con espacios quísticos llenos de secreciones mucinosas o serosas. Al microscopio suelen tener los huecos revestidos por doble capa epitelial sobre un estroma linfático denso que puede llegar a formar centros germinales. La capa superior epitelial suele ser una empalizada con citoplasma eosinófilo granulado (mitocondrias), mientras que la capa inferior está conformada por células cúbicas o poligonales con algunas células secretoras.
Carcinoma mucoepidermoide
Esta tumoración presenta un patrón mixto de células escamosas, células secretoras de moco y células intermedias. Es más común en la glándula parótida, pero suele presentarse en un porcentaje considerable de las glándulas salivales menores. Genéticamente, se asocia a la translocación (11;19) creando el gen de fusión MECT1-MAML29. Son tumores que macroscópicamente pueden alcanzar hasta 8 cm de diámetro, no tienen cápsula definida y suelen ser infiltrantes. Son de coloración tono pálido o gris blanquecino con pequeños quistes llenos de mucina. Microscópicamente, las células escamosas, mucosas o intermedias se arreglan en cordones, láminas o quistes. Se pueden subclasificar en bajo, intermedio o alto grado. Las neoplasias de alto grado suelen tener recaídas y metástasis lejanas hasta en 30% de los casos. La supervivencia a 5 años es de 50%1,9.
Carcinoma adenoideo quístico
Es un tumor muy raro; la mitad de los casos se presenta en las glándulas salivales menores, sobre todo las palatinas. Se caracteriza por ser infiltrante, mal encapsulado, pequeño y de color rosa grisáceo. Crece con lentitud, pero suele ser invasivo y tiene una tasa alta de recidiva. La mitad de estos tumores presentan metástasis a distancia, principalmente a hueso, hígado y cerebro, lo que disminuye drásticamente la supervivencia a 15 años.
Tratamiento
Después de una evaluación integral de los nódulos en cuello, se debe definir el tratamiento. A los pacientes con masas que sugieren origen inflamatorio se les debe brindar un curso de antibióticos con observación continua durante varias semanas. En el caso de las glándulas salivales, el tratamiento dependerá en gran medida de las características del tumor; la principal es su diferenciación entre masa benigna o maligna. Es importante manejar las tumoraciones comprendiendo la estructura y el proceso patológico que se están desarrollando.
El tratamiento más común para las tumoraciones es la extracción quirúrgica con márgenes negativos17. Las tumoraciones benignas y las malignas de bajo grado se deben tratar quirúrgicamente en la mayoría de los casos. Se deben extirpar completamente y con márgenes amplios para prevenir la recurrencia18. La cirugía que se puede proponer al paciente depende de la localización del tumor.
Las neoplasias malignas de alto grado con márgenes positivos, los carcinomas de alto grado con márgenes positivos y otras afecciones de alto grado se deben tratar quirúrgicamente y con radioterapia adyuvante, la cual es también útil en cánceres de alto grado con invasión perineural o vascular, invasión linfática, extensión extracapsular, tumores de las glándulas submandibulares, sublinguales o menores, y en los carcinomas adenoideos quísticos19,20,21.
El tratamiento del estadio no es muy controversial. Las recomendaciones dictan que se realice en pacientes con pobre pronóstico en metástasis ocultas: sitio y tamaño del tumor primario, extensión extraglandular, edad, síntomas a la presentación, tipo y grado histológico, invasión tisular local, márgenes positivos postquirúrgicos y expresión de marcadores moleculares (Ki-67 alto y p27 bajo)22,23,24.
En el caso de la glándula parótida se debe tomar en cuenta para la resección tumoral tamaño, invasión y relación con el nervio facial. La parotidectomía se puede clasificar en conservadora, superficial o total. La conservadora es menos extensa que la superficial y diseca parcialmente el nervio facial; la superficial se caracteriza por realizar una resección del lóbulo superficial y una disección de todas las ramas del nervio facial; y la total consiste en la disección y preservación del nervio facial con extracción de todo el tejido parotideo, incluyendo ambos lóbulos.
Las tumoraciones benignas, como los adenomas pleomórficos que se encuentran en la cola de la oreja, se pueden extraer con una parotidectomía superficial, mientras que aquellos que se encuentran en los lóbulos profundos requieren una parotidectomía conservadora. Cuando se presenta una malignidad, el grado histológico marcará la pauta de tratamiento. Aquellas de bajo grado y las de alto grado que se encuentran en la periferia del lóbulo superficial se pueden tratar con parotidectomía superficial. Los tumores de alto grado y profundos se tratan con una parotidectomía total. Ante cualquier tumoración, es de suma importancia tratar siempre de preservar el nervio facial cuando su funcionamiento previo a la cirugía está íntegro.
Los tumores en la glándula submandibular requieren una sialoadenectomía submandibular, porque alrededor de 50% de estos son malignos. El problema de realizar esta cirugía es que dicha glándula tiene a su alrededor estructuras de vital importancia, como la vena y arteria faciales, la rama mandibular del nervio facial, los nervios hipogloso y lingual y el conducto de Wharton. Los tumores mencionados tienen la mayor incidencia de metástasis a ganglios linfáticos cervicales, con un porcentaje de hasta 21% comparado con las parótidas, que solo alcanza 9%25. Se recomienda radioterapia (RT) adyuvante en todas las tumoraciones de esta glándula, excepto en las de bajo grado que se resecaron completamente19.
La glándula sublingual rara vez genera tumoraciones y cuando lo hace estas son malignas. El abordaje recomendado es la resección del piso de la boca, de la glándula sublingual enferma y de la glándula submandibular ipsilateral. Además, se sugiere una resección ganglionar electiva de los niveles I-III cuando se sabe antes de la cirugía que la tumoración es de alto grado.
La base del tratamiento de las tumoraciones en las glándulas salivales menores es la escisión quirúrgica. Se deben extirpar con márgenes de tejido blando y es necesario evitar la enucleación por el alto riesgo de recidiva18. En algunas ocasiones el tratamiento se puede brindar con RT, sin embargo se aconseja siempre la combinación de la resección quirúrgica seguida de la RT.
La disección ganglionar o linfadenectomía se debe considerar en todos los casos de cáncer de la parótida: cuando se encuentran ganglios crecidos (en el examen físico, en algún estudio de imagen o en una tomografía de emisión de positrones (PET) positiva), si el cáncer es de alto grado o si tiene características de metástasis. Las complicaciones de este procedimiento son mínimas e incluyen la posibilidad de encontrar parestesias en oído, debilidad para elevar los brazos y debilidad del labio inferior.
Pronóstico
En general, los tumores de glándulas salivales mayores tienen mejor pronóstico, los de la parótida mejor que los de la glándula submandibular. La disfunción del nervio facial, el tamaño, positividad en ganglios cervicales, invasión perineural, márgenes positivos, alto grado y la edad avanzada son factores de pronóstico malo26. La tasa de supervivencia global para tumores malignos de glándulas salivales es de 47 al 74%27,28.
El seguimiento postquirúrgico debe ser regular y estar dirigido a la educación del paciente. Se deben proporcionar los signos de alarma, como disfonía, dolor, disfagia, sangrado y crecimiento ganglionar. Entre 80 y 90% de las recurrencias ocurren en los primeros dos a cuatro años posteriores, por lo que el seguimiento periódico se recomienda durante los cinco años posteriores al diagnóstico y tratamiento17, 26.
- Flint P, Haughey B, Robbins K, Thomas J, Niparko J, Lund V and Lesperance M, Cummings Otolaryngology - Head and Neck Surgery. London: Elsevier Health Sciences; 2014.
- Cameron J and Cameron A. Current Surgical Therapy. 12th ed. Philadelphia, PA.: Elsevier Health Sciences; 2017. p.836-841.
- Haynes J, Arnold K, Aguirre-Oskins C and Chandra S. Evaluation of Neck Masses in Adults. Ann Fam Med. 2015; 91(10):698-706.
- Medina-Franco H. Oncología Clínica. 1ª ed. Ciudad de México: PyDESA; 2013.
- Goffart Y, Hamoir M, Deron P, Claes J and Remacle M. Management of neck masses in adults. B-ENT. 2005;1(1):133-142.
- Sood S, McGurk M and Vaz F. Management of Salivary Gland Tumours: United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol. 2016;130(S2):S142-S149.
- Robbins K, Clayman G, Levine P, Medina J, Sessions R, Shaha A, Som P and Wolf G. Neck Dissection Classification Update. Arch Otolaryngol Head Neck Surg. 2002;128(7):751.
- Spiro RH. Salivary neoplasms: overview of a 35-year experience with 2,807 patients. Head Neck Surg. 1986 Jan-Feb;8(3):177-84.
- Kumar V, Abbas A and Aster J. Robbins and Cotran pathologic basis of disease. 9th ed. Philidelphia: Elsevier; 2015.
- Weber A, Romo L. and Hashmi S. Malignant tumors of the oral cavity and oropharynx: clinical, pathologic, and radiologic evaluation. Neuroimaging Clin N Am. 2003;13(3):443-464.
- Lee Y, Wong K, King A and Ahuja A. Imaging of salivary gland tumours. European Journal of Radiology. 2008;66(3):419-436.
- Al-Khafaji BM, Afify AM. Salivary gland fine needle aspiration using the ThinPrep technique: diagnostic accuracy, cytologic artifacts and pitfalls. Acta Cytol 2001;45:567-74.
- Gonçalves A, Menezes M, Kavabata N, Bertelli A, Souza R. and Joelsons D. Punção aspirativa nos tumores das glândulas salivares: especificidade e sensibilidade. Rev Assoc Méd Brasil.2007;53(3):267-271.
- Feld R, Nazarian LN, Needleman L et al.. Clinical impact of sonographically guided biopsy of salivary gland masses and surrounding lymph nodes. Ear Nose Throat J 1999;78(12):905, 908-912.
- Heller K, Dubner S, Chess Q and Attie J. Value of fine needle aspiration biopsy of salivary gland masses in clinical decision-making. Am J. Surg 1992;164:667–670.
- Major salivary glands (parotid, submandibular, and sublingual). In: Edge SB BD, Compton CC et al., (eds). AJCC Cancer Staging Manual. 7th ed. New York, NY: Springer; 2010. p. 79-82.
- The American Cancer Society medical and editorial content team. Surgery for Salivary Gland Cancer [online]. Cancer.org; (2017). Available at: https://www.cancer.org/cancer/salivary-gland-cancer/treating/surgery.html [Accessed 16 Aug. 2017].
- Witt RL. The significance of the margin in parotid surgery for pleomorphic Laryngoscope. 2002 Dec;112(12):2141-54.
- Terhaard CH, Lubsen H, Rasch CR et al. The role of radiotherapy in the treatment of malignant salivary gland tumors. Int J Radiat Oncol Biol Phys . 2005;61:103-11.
- Silverman DA, Carlson TP, Khuntia D, Bergstrom RT, Saxton J, Esclamado RM. Role for postoperative radiation therapy in adenoid cystic carcinoma of the head and neck. Laryngoscope. 2004;114:1194-9.
- Chen AM, Granchi PJ, Garcia J, Bucci MK, Fu KK, Eisele DW. Local-regional recurrence after surgery without postoperative irradiation for carcinomas of the major salivary glands: implications for adjuvant therapy. Int J Radiat Oncol Biol Phys. 2007;67(4):982-7.
- Lima RA, Tavares MR, Dias FL et al. Clinical prognostic factors in malignant parotid gland tumors. Otolaryngol Head Neck Surg 2005;133:702-8.
- Hocwald E, Korkmaz H, Yoo GH et al. Prognostic factors in major salivary gland cancer. Laryngoscope. 2001;111:1434-9.
- Miyabe S, Okabe M, Nagatsuka H et al. Prognostic significance of p27Kip1, Ki-67, and CRTC1-MAML2 fusion transcript in mucoepidermoid carcinoma: a molecular and clinicopathologic study of 101 cases. J Oral Maxillofac Surg. 2009;67:1432-41.
- Armstrong JG, Harrison LB, Thaler HT et al. The indications for elective treatment of the neck in cancer of the major salivary glands. Cancer. 1992;69:615-9.
- Hocwald E, Korkmaz H, Yoo GH et al. Prognostic factors in major salivary gland cancer. Laryngoscope. 2001;111:1434-9.
- Renehan A, Gleave E, Hancock BD, Smith P, McGurk M. Long-term follow-up of over 1000 patients with salivary gland tumours treated in a single centre. Br J Surg. 1996;83:1750-4.
- Spiro RH, Armstrong J, Harrison L, Geller NL, Lin SY, Strong EW. Carcinoma of major salivary glands. Recent trends. Arch Otolaryngol Head Neck Surg. 1989;115:316-21.

